

Innhold:
Radioaktivitet
Noen historiske forsøk og oppdagelser
Undervisning om emisjon og absorbsjon
Når vi skal undervise om atomet, støter vi i hovedsak på to pedagogiske utfordringer. På den ene siden har vi problemet med å undervise noe som i seg selv er "ufornuftig". Dette har vi skrevet litt om foran. På den andre siden inneholder atommodellene endel kvantitative størrelser som er vanskelige å fatte. Atomene er så uendelig mye mindre enn alt vi kjenner og så finnes det så uendelig mange flere av dem enn det vi kan telle. Før vi går over til emnet radioaktivitet, vil vi kort nevne den pedagogiske utfordringene som ligger i å kvantifisere atomer. Radioaktivitet er en del av hverdagen fordi den på den ene siden gir oss energi, og på den andre siden har den gitt oss et stråleproblem. Problemet for vanlige mennesker er å få et rett kvantitativt bilde av det som har med radioaktivitet å gjøre. Etter reaktorulykken i Tsjernobyl var det antydninger til overreaksjon og panikk som følge av manglende forståelse for de måleverdiene som ble offentliggjort. Her ønsker vi å gi en bakgrunn for å kunne takle informasjon om radioaktivitet på en fornuftig måte.
Antall atomer i en vanndråpe
Et eksempel på problemene med å forstå store tall, får vi om vi tar utgangspunkt i en dråpe vann. Vi kan f.eks. telle dråper fra en vannkran og finner da kanskje at det går 20 dråper på en milliliter (=1 gram). Det vil si at det er 20 000 dråper i en liter. Dette er et stort tall. Om vi skulle telle dråpene før vi drikker dem, ville vi kanskje tørstet i hjel. Siden dette heftet handler om atomer er det kanskje naturlig å spørre hvor mange atomer som finnes i en dråpe vann. I
kjemien har vi da lært at 18 g vann inneholder 6,02·1023 molekyl (Avogadros tall). Det er videre tre atom i hvert vannmolekyl (H2O) og vi må da dividere ovennevnte tall med 18*20*3=1080 for å finne antall atom i en dråpe. Antallet blir 5,6·1020. Hvor mange atom er egentlig dette? Det enkleste er vel å si at det er ufattelig mange. Hvis alle mennesker på jorda ble satt til å telle, ett atom pr sekund, dag og natt i hele sin levetid ville de ikke klart å telle atomene i en vanndråpe. Dette illustrerer problemene med å fatte størrelse og antall når det gjelder atomer. Vi må bare innrømme vår begrensning. Men det betyr ikke at vi bør gi opp når det gjelder å skaffe oss en kvantitativ forståelse for hva atomene betyr for oss.
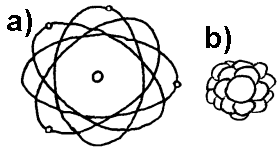
Tegninger og figurer av atomer består vanligvis av en kjerne med endel protoner og nøytroner og endel elektroner i baner rundt. Som vi har nevnt tidligere stemmer den fremstillingen sannsynligvis ikke med virkeligheten. De "gamle" tegningene brukes imidlertid fortsatt siden kvantefysikken ikke har gitt noen bedre måte å tegne et atom.
Når det gjelder den aktuelle figuren av atomkjerne som da også er typisk for hvordan atomkjernen fremstilles i lærebøker, så er det de pedagogiske problemene med disse mindre kjent enn problemene med figurene av hele atomer. Nå er det ikke noe poeng her å kritisere de atommodellene som finnes i lærebøker, men siden de kan skape læringsproblemer for elevene er det viktig at lærere er oppmerksom de ulike problemene som kan dukke opp. Vi vil derfor innledningsvis gi en kort beskrive av problemet, men i fortsettelsen vil vi da bruke de modellene for atomkjernene som vanligvis brukes. En grunn for dette er at man i noen tilfeller kan oppleve at hvis man er blitt vant til en modell, så kan man risikere at det oppstår forvirring om en ny og bedre modell kommer på banen uten at det er avsatt tilstrekkelig tid til å forklare den nye modellen.
Når bør vi bruke grunnstoff og når bør vi bruke
isotop?
Når vi skal lære elever om atom, så trenger
man noen kategorier som de ulike atomene kan plasseres i. To slike kategorityper
er grunnstoff og isotop og det er vel en utbredt tro at grunnstoff
er en mer grunnleggende kategori enn isotop. Det betyr f.eks. at et grunnstoff
vil bestå av ulike isotoper, og at det er lettere å skille mellom
grunnstoff enn isotoper.

Problemet her er at jo klarer man prøver å gjøre definisjonene av disse kategoriene, jo vanskeligere blir det å forstå virkeligheten, og her vil vi bruke de isotopene som er vist i figuren til høyre for å illustrere problemet.
I utgangspunktet er kategorien grunnstoff basert på kjemiske egenskaper og de atomene som tilhører samme grunnstoff har da samme kjemiske egenskap. Det er da primært antall ytre elektroner (de som inngår i kjemiske bindinger) som bestemmer de kjemiske egenskapene til et atom, men også andre faktorer som total antall partikler betyr litt. Hvert grunnstoff har da hvert sitt atommnummer, men siden de også har et entydig symboler det sjeldent at atomnummeret brukes til annet enn å sortere grunnstoffene. På den andre siden er det massen eller totale antall partikler som skiller de ulike isotopene fra hverandre. I denne sammenhengen har man da et isotopnummer som er tatt med i oversikten til høyre. Ifølge vanlige lærebøker så representerer isotopnummeret antall kjernepartikler (proton og nøytron) mens de ifølge em-modellen representerer antall proton.
Mindre dogmatisme ville sannsynligvis medføre større forståelse
La
oss her tenke oss at vi har et C-14 atom som er kategorisert som grunnstoffet
karbon fordi de oppfører seg som karbon som da har fire ytre elektroner
som inngår i ulike bindinger. Nå er dette atomet også radioaktivt,
Det betyr at det kan sende ut en beta-partikkel som da er et elektron og
det blir da plutselig omdannet til et annet grunnstoff, nemlig nitrogen og nærmere
bestemt isotopen N-14. På tilsvarende måte kan også et N-14
atom omdannes til C-14 om de treffes av et raskt elektron. Et hovedproblem er
da å forstå hva som skjer når det tilsynelatende utveksles
elektron med atomkjernen som ifølge de vanlige beskrivelsene ikke inneholder
elektron. Et annet problem er å skjønne hvorfor denne utsendelsen
av et elektron medfører at et atom skifter fra å være
et karbonatom som har fire ytre elektron til et nitrogenatom som har fem ytre
elektron. Her vil vi bare kort nevne at det finnes elektroner i atomkjernen
ifølge em-modellen og det at et slikt elektron spretter ut med høy
hastighet vil da medføre at det gjenværende atomet får en
positiv ladning totalt sett, Det vil følgelig trekke til seg et ekstra
elektron og dermed få fem ytre elektron og begynne å oppføre
seg som et nitrogenatom. Tilsvarende kan det tenkes at et nitrogenatom får
tilført et ekstra elektron til kjernen og den ekstra negative ladningen
vl da medfører at atomet vil gi slipp på et ytre eletron og begynne
å oppføre seg som et karbonatom.
Et poeng here er at det er relativt vanlig at elektron kan hoppe ut og inn av både de ytre og de indre delene av atomet, og når det skjer en endring i indre deler (kjernen), vil vi få en overgang fra et grunnstoff til et annet. På den andre siden er det sjeldent at lærebøkenes kjernepartikler (nøytron eller elektron) hopper ut eller inn. Ifølge sunn fornuft (og em-modellen) er da et nøytron rett og slett et elektron pluss et proton, og pedagogisk sett hadde det sannsynligvis vært enklere for elevene om man kunne snakke om elektron og proton i kjernen i stedet for nøytron. Men utfra den responsen jeg har fått når jeg har antydet dette, forstår jeg vel at lærebokforfattere kvier seg for å skrive det. Sannsynligvis finnes det ikke noe som motbeviser at et nøytron egentlig består av et elektron og et proton. Kanskje er det nettopp derfor at noen reagerer også sterkt når det blir forslått. Her vil jeg da bare gjenta at det er uheldig om læreren blir for dogmatiske med å fornekte at det finnes elektroner i kjernen eller forsvare at grunnstoff er en grunnleggende og stabil kategori, når man i praksis har erfart at atom relativt lett kan gå over fra et grunnstoff til et annet ved å miste eller få tilført et raskt elektron.
Litt om påvising av isotop og grunnstoff
Nå finnes det ulike kjemiske metoder
for å påvise hva slags atomer man har i en prøve. En grunnleggende
forutsetning er imidlertid at det må være et visst antall av en type
atom før vi klarer å påvise stoffet. Om målet
er å føre kontroll med omdanninger fra et stoff til et annet,
så kan også dette skje ved hjelp av kjemiske metoder, men fortsatt
gjelder altså prinsippet om at antall nye atom/molekyl må overstige
en viss nedre grense før vi kan påvise dem kjemisk. Vi kan
altså ikke oppdage kjemisk at det finnes f.eks. et gull-atom i en
prøve.
Nå finnes det imidlertid en annen måte å påvise omdanninger fra et stoff til et annet når det skjer en såkalt radioaktiv omdanning. En slik overgang vil nemlig forårsake utsendelse av radioaktiv stråling (energi ) som fremkommer som et "klikk" i måleinstrumentet. Nå er det vanskelig å si noe sikkert om hva slags prosess som har forårsaket et bestemt klikk, men det er vanlig å gjøre noen antagelser, og generelt kan vi ved å telle slike klikk, få en relativt nøyaktig verdi for hvor mye som har endret seg i de aktuelle prøvene vi studerer. Radioaktive målinger representerer med andre orden svært nøyaktig metode for å beregne mengde av noen atomtyper/isotoper i en prøve.

Et kjennetegn på radioaktivitet er at den strålingen vi observerer har relativt stor intensitet eller energikonsentrasjon. Det er altså mye energi i hver energiutsendelse selv om det vanligvis er snakk om relativt få slike energiutsendelser og lite energi totalt sett. Nå har det vist seg at det finnes ganske mange såkalte radioaktive eller ustabile isotoper i de stoffene som omgir oss. Metoden vi bruker for å påvise dem er rett og slett å telle den radioaktive energiutsendelsen fra disse stoffene. Når et atom omdannes til et annet og sender ut radioaktiv stråling, kalles det en disintegrasjon. Vi skal komme tilbake til hvorfor vi kan bruke antall disintegrasjoner til å si noe om hvor mange radioaktive isotoper som er igjen og som ikke har disintegrert. Her vil vi bare si at enkle opptellinger av disintegrasjoner kan gi oss svært nøyaktige data om hvilke ustabile isotoper som finnes i en prøve. Radioaktiv stråling kalles også ofte for ioniserende stråling. Dette kommer av at denne strålingen kan løsrive elektroner fra vanlige organiske stoff, og følgelig blir det dannet ion. Skjer dette i levende vev, vil det ofte medføre at cellen eller celledelen slutter å fungere, og dette er da grunnen til at vi bør unngå radioaktiv stråling. Til vanlig skjer imidlertid slike ødeleggelser så sjeldent at kroppen klarer å reparerer skadene mellom hver gang.
Nå har vi ikke noen sanser som direkte kan oppfatte den strålingen som kommer fra atomkjernene. Vi kan imidlertid indirekte oppdage slik stråling fordi den kan forårsake sykdom og død. Dette har hovedsaklig skjedd etter at menneskene selv begynte å samle radioaktive stoff i større konsentrasjoner i forbindelse med atomkraftverk og atombomber. Før dette var de radioaktive strålene så spredt og skadevirkningen var så små at skadevirkningene var relativt liten.
Hvordan kan vi "se" radioaktiv stråling
På samme måte som vi trenger en radiomottaker for å oppdage radiobølger trenger vi et instrument for å oppdage radioaktiv stråling. Franskmannen Antoine-Henri Becquerel oppdaget radioaktiviteten ved en tilfeldighet da en stein med uransalt hadde svertet en fotografisk plate. Fotografisk film blir altså påvirket av radioaktiv stråling. Radioaktiv stråling kan også få fluoreserende stoff til å lyse. Dette prinsippet ble tidligere brukt på visere på armbåndsur for at disse skulle lyse i mørket. Slike klokker selges vel ikke lenger
på grunn av at radioaktiv stråling er skadelig.
Theodor Wolf målte i 1910 radioaktiviteten oppe i Eiffeltårnet og påviste at radioaktiviteten økte med høyden over bakken. Dette skjedde 18 år før GM-telleren ble oppfunnet. Sannsynligvis brukte han fotografiske plater da han gjorde forsøkene. Årsaken er at den naturlige radioaktiviteten er så liten at den det er vanskelig å tenke seg at den i seg selv får fluoreserende stoff til å lyse.
Nå finnes det et relativt enkelt apparat som kan brukes for å se radioaktivitet som kalles spintariskop. Det kan kjøpes fra pedagogiske firma. Prinsippet for dette er at fluoreserende stoff vil sende ut et ørlite lysglimt når det treffes av a-partikler fra en innebygget radioaktiv kilde. Problemet med dette er imidlertid at det må være helt mørkt og øyet må ha vent seg til mørket for å se lysglimtene. Det passer derfor best å bruke det under dyna etter at vi har lagt oss.
Den personen som gjorde den største innsatsen for å forstå de radioaktive egenskapene til atomene rundt århundreskiftet, var vel polskfødte Marie Curie. Hun la ned et stort og systematisk arbeid i å isolere radioaktive stoff, og som en anerkjennelse av dette fikk et nyoppdaget grunnstoff, Polonium, navnet etter Marie sitt hjemland. Marie Curie døde i 1934 av en ondartet blodsykdom som sannsynligvis var forårsaket av hennes nærkontakt med radioaktive stoff over mange år.

Den viktigste enkelthendelsen i studiene av radioaktive stoff var kanskje oppfinnelsen av Geiger-Müller-røret i 1928, oppkalt etter oppfinnerne. Ved hjelp av dette ble det da mulig å få en umiddelbar og nøyaktig verdi for radioaktiviteten. Prinsippet for GM-røret er ganske enkelt. Det består av en metallsylinder med en metalltråd i midten. Mellom disse er det da en blanding av en edelgass (neon eller argon) og et halogen (brom eller klor). Det settes så en spenning på noen hundre volt mellom metallsylinderen og metalltråden i midten. Virkemåten er da at en ioniserende partikkel eller stråle, som kommer inn i røret, vil ionisere et atom fra edelgassen. Dette elektronet vil da trekkes mot den positive elektroden i midten. Men på vegen vil den treffe andre atom og ionisere disse, og til slutt vil derfor et helt skred av elektroner treffe elektroden. Dette lager da en elektrisk puls som blir registrert i GM-telleren. Ofte er det koplet til en høyttaler slik at vi kan høre pulsene som et klikk.
I dag finnes det ulike GM-rør. Generelt kan vi dele dem i to typer. Den ene typen er beregnet på α- og β-stråling. Siden disse lett lar seg stoppe må et slikt rør ha et tynt vindu som strålene kan slippe gjennom. Dette røret registrerer da også røntgenstråling. Den andre typen rør er spesielt beregnet på å registrere mest mulig røntgenstråling. Siden røntgenstråling er vanskelig å stoppe er det ikke nødvendig med et vindu i dette tilfellet. Problemet her er heller å lage en anordning som stopper disse strålene slik at de kan bli registrert. Dette skjer da som regel ved at gammastrålene blir absorbert i metallrøret rundt. Generelt regner vi med at 99% av gammastrålene går gjennom et slikt GM-rør uten å bli registrert. Et GM-rør koster vanligvis noen få tusen. Det betyr vel at dette utstyret ikke finnes i alle grunnskoler. Selve GM telleren er da ofte en kombinert spenningskilde til røret samt en digital teller som kan telle opp antall pulser.
Til skolebruk er GM-teller mest aktuelt. I større forskermiljø og i sammenhenger hvor radioaktive målinger er rutine, brukes det også andre måleinstrument for radioaktivitet. Scintillasjonsteller inneholder f.eks. et fast gjennomsiktig stoff (NaI el.l.). Radioaktiv stråling forårsaker da lysglimt i dette stoffet som i sin tur blir registrert av sensorer. Hovedfortrinnet med dette måleinstrumentet er at intensiteten på lysglimtet sier noe om energien i den radioaktive strålingen. Halvledere kan også brukes til å registrere radioaktiv stråling.
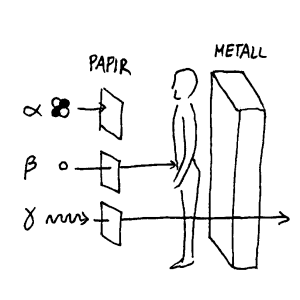
Som nevnt foran finnes det ulike typer radioaktiv stråling. Disse har ulike egenskaper og trenger derfor ulike instrument for å måles. Gammastråling (γ-stråling) er elektromagnetisk stråling med svære høy frekvens. Denne kan gå gjennom det meste. Det kreves relativt tykke blyplater for å stoppe denne strålingen. Det betyr igjen at et måleinstrument som skal måle denne strålingen vil oppdage i størrelsesorden en prosent av denne strålingen. Resten av strålingen vil da bare gå rett gjennom måleinstrumentet. Beta-stråling (β-stråling) er elektroner med høy hastighet. Erfaringer viser at denne kan gå gjennom et papirark og liknende, men at den f.eks. ikke vil trenge langt inn i huda vår. Denne strålingen krever av måleinstrumentet at det har et vindu som slipper disse strålene gjennom. Alfa-stråling (α-stråling) er heliumkjerner som har positiv ladning, og de er derfor relativt store. Disse stoppes av f.eks. et papirark, og de vil derfor heller ikke trenge inn gjennom huda vår utenfra. De måleinstrumentene som skal måle disse strålene trenger også et vindu, som er svært tynt (og dermed lett å skade), for at denne strålingen skal slippe inn og registreres. Disse tre typene av stråling stammer fra vanlige radioaktive stoff her på jorda, men den kan også komme fra universet.
Hva skjer i atomet når det forårsaker stråling?
Om vi i utgangspunktet har et radioaktivt stoff med en ustabil kjerne, vet vi at kjernen før eller siden vil kunne endres. Et av følgende kan da skje:
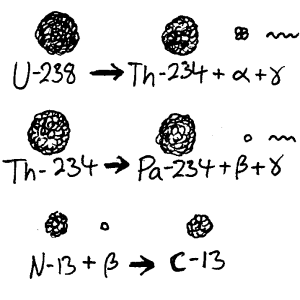
Utsending av α-partikkel: En α-partikkel kan sendes ut. Ofte følges dette av utsendelse av gammastråling. Atomet har med andre ord mistet to protoner og to nøytroner. Isotopen U-238 kan f.eks. bli til Th-234.
Utsending av β-partikkel: Et nøytron kan omdannes til proton og elektron. Elektronet vil da sendes ut av atomet som β-stråling. Grunnstoffet vil endre seg fordi protontallet endrer seg. Et eksempel er Th-234 som blir omdannet til Pa-234. Også i slike tilfeller kan vi få gammastråling.
Opptak av elektron (elektron capture): Et elektron kan også fanges opp av kjernen. Et proton vil da endres til et nøytron og atomet vil endre kjemiske egenskaper. Dette er da også ødeleggende om det skjer i levende organisk vev.
Stoff |
Atomnummer |
Symbol |
Massetall |
Stråling/forekomst |
Halveringstid |
|
karbon |
6 |
C |
11 |
b+ |
20,3min |
|
karbon |
6 |
C |
12 |
98,89% |
stabil |
|
karbon |
6 |
C |
13 |
1,11% |
stabil |
|
karbon |
6 |
C |
14 |
b- |
5730 år |
|
uran |
92 |
U |
238 |
a/99,2746% |
4,5·109 år |
Tabellen ovenfor viser eksempler hvordan ulike radioaktive stoff kan angies i tabeller. Merk at C-11 vil ta opp et elektron mens C-14 vil sende ut et elektron. J
Radioaktiv halveringstid er et begrep som ofte blir nevnt i forbindelse med radioaktivitet. Halveringstid betyr da rett og slett den tiden det tar før halvdelen av det ustabile/radioaktive stoffet i en prøve blir omdannet til andre stoff. Det har vist seg at dette er en fast verdi som karakteriserer de ulike stoffene.
Litt matematikk
Siden radioaktiv stråling kan være farlig er det viktig for oss å finne fram til presise måter å kvantifisere radioaktivitet. Her vil vi prøve å gi en praktisk innføring
i den litt vanskelige matematikken som ligger bak de formlene som gjelder for radioaktivitet. Generelt vil vel de fleste oppleve
det som naturlig at strålingen (I) blir større jo flere radioaktive atom vi har (N) og jo raskere disse omdannes. Som et første forsøk på å lage
et matematisk uttrykk for dette kan vi tenke på et stearinlys.

Et stearinlyseksempel
Strålingen
fra et stearinlys følger følgende formel:
I=k
Denne likningen sier da at strålingen er konstant. Stearinlyset er et eksempel på en naturlig prosess hvor reduksjonen av stearin (N) skjer lineært. Omdanningen av stearin til gasser skjer altså med tilnærmet konstant hastighet. Det vil si at hvis vi tegner en kurve over reduksjonen vil den bli ei rett linje. Om vi lar N være antall molekyl som er igjen i stearinlyset til enhver tid vil vi få følgende sammenheng mellom N og tida t:
N=N0-kt
N0 er da det opprinnelige antallet molekyl ved starten og k er en konstant som sier noe om omdanningshastigheten. Figuren vises en kurve for denne ligningen. Om vi i stedet for det totale antallet atomer (N) er interessert i forandringen av antall atomer (ΔN) er det ikke så vanskelig å overbevise seg selv om at denne må være konstant. Med det mener vi at om stearinlyset mister en million molekyl på ett sekund så vil det også miste en million molekyl det neste sekundet. Skal vi uttrykke dette på matematisk form blir likningen:
ΔN= N0-N=-k·Δt
Her skjer endringen over et kjent lite tidsrom (Δt). Minustegnet markerer at det her er snakk om en reduksjon av antall molekyl.
Utledning av formler for radioaktiv omdanning
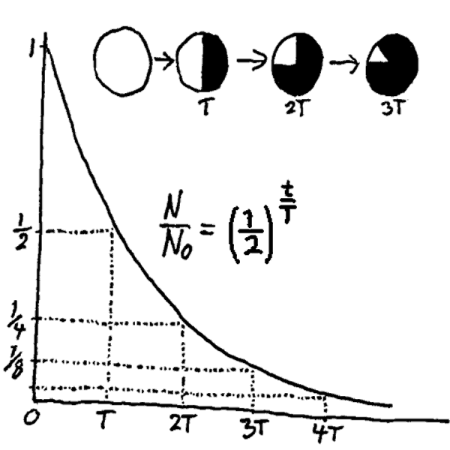
Om vi så i stedet for et stearinlys ser på omdanningen av radioaktive stoff, har vi ikke lenger en lineær sammenheng. Det vi vet i tilfelle med radioaktive stoff, er at tiden for å halvere antall radioaktive atomer er konstant.
Å halvere noe betyr i praksis å gange med 1/2 og vi kan da sette
opp følgende likning
N=N0 ·(1/2)x
hvor x står for antall halveringer. x blir da lik 1 når medgått tid (t) er lik halveringstiden (T) og generelt vil vi da ha sammenhengen: x=t/T. Vi får da følgende formel som gir sammenheng mellom medgått tid (t) og mengde av radioaktivt stoff (N) når startmengden (N0) og halveringstiden (T) er kjent:
N=N0 ·(1/2)t/T
Denne formelen er da enkel å bruke om spørsmålet er hvor mye radioaktivt stoff vi har igjen (N) eller hvor mye som er forsvunnet (N0-N) etter en oppgitt tid. Eksempel: Hvor stor andel C-14 vil være igjen i en trestokk etter 100 år?
Gjenværende C-14 etter 100 år: N/N0=(1/2)t/T=(1/2)100/5730=0,988=98,8%
Hvis vi derimot har oppgitt (målt) mengden av radioaktivt stoff og i stedet ønsker å vite hvor lang tid det har skjedd en radioaktiv omdanning, så blir matematikken litt mer komplisert. Eksempel: Innholdet C-14 i en trestokk er 90% av innholdet i omgivelsene som vi da antar er det innholdet trestokken hadde da treet ble felt. Hvor gammel er trestokken? Når vi setter inn opplysningene i formelen ovenfor får vi:
90=100·(1/2)t/5730 som kan forenkles til: 0,9=0,5t/5730
For å komme videre kan vi så ta logaritmen på hver side:
log(0,9)=log(0,5)·(t/5730) som
gir:
Tid for 10% C-14 reduksjon: t=5730år·log(0,9)/log(0,5)=871
år
Merk ellers at om vi bruker antall disintegrasjoner som vi f.eks får fra GM-måler, så kan vi f.eks. benevne dette antallet ΔN og følgende sammenheng blir da også aktuell:
ΔN=N0-N
Merk videre at siden radioaktiviteten (A) er definert som antall disintegrasjoner pr tidsenhet, så gjelder følgende formel også for radioaktivitet:
A=A0 ·(1/2)t/T

Nå er formlene ovenfor nyttige i ulike sammenhenger. Her vil vi kort si litt mer om radioaktiv datering. Vi kan i dag relativt nøyaktig finne halveringstiden for ulike stoff ved å telle "klikk". Generelt er det naturlig å anta at denne halveringstiden også var den samme i tidligere tider. Har vi f.eks. et stoff med en halveringstid på minutter, vil dette være borte etter noen dager. Har vi et stoff med halveringstid på flere år, vil nedbrytingen av dette stoffet ta mange år. Om vi da kjenner startforholdene kan vi i prinsippet beregne hvor gammelt et radioaktivt stoff er etter at vi har analysert hvor mye radioaktivt stoff som er igjen i dag. Det at ulike radioaktive stoff har en fast halveringstid, er da et av argumentene for at vi kan bruke radioaktive stoff for å bestemme alder på ulike gjenstander eller bergarter. Nå vil vi ikke gå så dypt inn i diskusjonen om hvor pålitelig radioaktive dateringsmetoder er. Her vil vi bare si at de mest problematiske antakelsene som ligger til grunn for radioaktiv dateringsmetoder er:
1) Startbetingelsene er kjent(mengdeforhold da stoffene ble dannet)
2) At det ikke har vært lekkasje eller utveksling av stoff med omgivelsene i ettertid.
Uran er et naturlig forekommende radioaktivt stoff med halveringstid på milliarder år, og dette er da brukt for å bestemme alderen på geologiske formasjoner. Problemet med uran er at det f.eks. løses opp i vann og følgelig vet vi ikke om uran har blitt utvekslet med omgivelsene. Videre vet vi heller ikke hvor mye bly som var i de opprinnelige bergartene. Bly er et såkalt datterprodukt av uran, og vi kan altså ikke si noe sikkert om hvor mye det var av disse to stoffene i bergartene da de ble dannet.
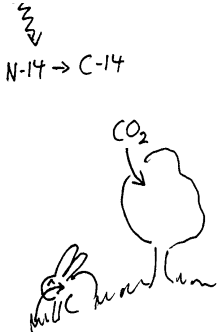
Aldersdatering ved hjelp av C-14 Et annet stoff som også brukes til radioaktiv datering av organisk stoff som er noen tusen år gammelt er C-14. Her vil vi generelt si at denne dateringsmetoden har vist seg relativt pålitelig i de tilfellene vi har kunnet kontrollere den, men det finnes argumenter for at vi ikke bør stole for mye på de høyeste aldrene. Noen mener vel at den er brukbar opptil 10 000 år. Dette kan diskuteres, men vi vil ikke gå inn på denne debatten her. Her vil vi imidlertid si litt generelt om hvorfor man mener at man kjenner det opprinnelige antallet C-14 i en prøve (N0) I de øvre delene av atmosfæren er det relativt mye kosmisk stråling. Denne strålingen omdanner blant annet nitrogen (N-14) til C-14. Denne nye isotopen vil oppføre seg som vanlig karbon og inngå i de vanlige stoffkretsløpene i levende organismer. Luft vil blandes og vi får da et bestemt forhold mellom vanlig karbon (C-12) og C-14 i atmosfæren. Siden plantene opptar karbon (C02) fra luften og menneskene spiser planter vil alt levende ha samme forhold mellom C-12 og C-14 som i atmosfæren. Når så en plante eller et dyr dør vil utvekslingen av karbon med atmosfæren opphøre. Da vil innholdet av C-14 avta med tida mens innholdet av C-12 ikke endres. C-14 har en halveringstid på 5730 år og derfor vil halvdelen være omdannet til N-14 etter en slik tidsperiode. Nå er det imidlertid ikke sikkert at de beregningene man har gjort av C-14 innhold i atmosfæren bakover i tiden er korrekt, og derfor er også denne metoden usikker ved høye aldrer.
Konsentrasjon av C-14 i levende materiale i dag er slik at vi får 13 disintegrasjoner pr. gram karbon pr min. For å kunne måle så små mengder med den nøyaktigheten som trenges, må vi skjerme prøvene med minst 10 cm bly og ren karbon må isoleres ved å varme opp det organiske materialet slik at Hydrogen og Oksygen forsvinner. I den kullprøven som vi så måler på, vil vi kanskje maksimalt oppdage 5 % av β-strålingen fordi resten absorberes av kullet o.a. I dag brukes vanligvis ikke kull, men karbondioksid-gass når vi skal måle C-14 konsentrasjonen i en prøve. Karbondioksidgass fra prøven sendes da inn i et godt skjermet rør. I dette tilfellet skal det være mulig å oppdage mer av β-strålingen fordi den ikke absorberes av gassen selv. For å illustrere at det er vanskelig å bruke vanlig GM-teller til C-14 datering kan vi si at ca. 1 av 500 registreringer på en vanlig Geiger-teller ha sin årsak i C-14.
Et eksempel I levende organismer vil det være 13 desintegrasjoner av C-14 pr gram karbon pr minutt. Hva vil så denne verdien være for en trestokk som er 100 år gammel. Halveringstiden for C-14 er 5730 år. Ovenfor fant vi at C-14 innholdet vil bli redusert med 98,8% i løpet av 100 år og følgelig vil det da være snakk om 13*0,988=12,8 desintegrasjoner pr gram i en 100 år gammel trestokk.
Hvor kommer de radioaktive stoffene fra?
Nå er det relativt få naturlige radioaktive stoff på jorda. Med naturlige stoff mener vi da slike stoff som ikke har blitt dannet i nyere tid, men som har vært i naturen fra jordens skapelse. Et eksempel på et naturlig radioaktivt stoff er U-238 som brukes som brennstoff i kjernekraftverk. Det er imidlertid ikke bare de naturlige stoffene som sender ut den strålingen vi måler. Når et stabilt/ikke-radioaktivt atom treffes av stråling, kan vi få endring i antall protoner og nøytroner. Som eksempel kan et aluminiumatom endre seg til et fosforatom (P-30) om en a-partikkel trenger seg inn i kjernen. Denne fosforisotopen er ustabil med halveringstid ca 3 minutter. Også nøytroner og elektroner kan trenge inn i en kjerne og gjøre kjernen ustabil. Vi har altså den situasjonen radioaktive stoff som samles vil lage stråling som så i sin tur gjør andre stoff radioaktive.

Generelt om radioaktive isotoper
Når det i dag finnes mange radioaktive isotoper omkring oss med relativ kort halveringstid, så er det vanlig å anta at disse er blitt dannet som følge av annen radioaktiv stråling. Noen av disse stoffene dannes naturlig som følge av f.eks. kosmisk stråling. Et eksempel er C-14. Andre ustabile stoff er dannet i forbindelse med atomkraftverk og produksjon av kjernevåpen. Disse har vært i nærheten av radioaktive stoff og dermed selv blitt radioaktive. I forbindelse med kjernekraftulykken i Tsjernobyl var det slike nyskapte radioaktive stoff vi var mest redd for, og ikke den opprinnelige uranen. I dag kjenner vi over 1000 ustabile eller radioaktive isotoper som vi regner er blitt til som følge av at stabile stoff er blitt utsatt for bestråling. Det som da gjør disse stoffene så farlige er at de ofte har kjemiske egenskaper som svarer til andre stoffer som vi får i oss i gjennom maten. Disse stoffene kan da bygges inn i det organiske vevet. Når de så før eller senere går over til et annet mer stabilt stoff, vil det sannsynligvis ødelegge den strukturen det er en del av samtidig med at det vil skade annen strukturer i nærheten med den strålingen den sender ut. Et eksempel på en slik isotop er Kalium-40 som lett taes opp av organismen. Den kan derfor forårsake skader i organismene. Denne isotopen forekommer naturlig sammen med annen kalium i et forhold på omkring 0,012%. Halveringstiden til denne isotopen er 1,3 milliarder år og den representerer derfor ikke så store strålingsdoser. Om vi derimot får i oss tilsvarende stoff med en mye lavere halveringstid, kan frekvensen av kjemisk omdanning og stråling bli relativt stor i kroppen vår.

Fisjon og fusjon
I tillegg til en
stadig omdanning av radioaktive stoff som sender ut mindre mengder energi i
form av radioaktiv stråling, så har det vist seg at det er mulig
å øke hastigheten i disse prossessene dramatisk under visse betingelser.
En slik energifrigjøring har vi i atomkraftverk og atombomber. Et kjennetegn på de stoffene som kan brukes i atombomber er at de enten har store eller små kjerner. Her vil vi kort prøve å forklare hvorfor vi kan få ut store mengder energi fra slike atom, men ikke fra mellomstore atom som f.eks. jern.
Fisjon. Når store kjerner deles opp vil hver del kunne falle tettere sammen, og energiforskjellen vil bli frigjort. Dette skjer i atomreaktorer og atombomber. Generelt sett kan vi forestille oss at kjernepartiklene blir liggende tettere sammen.
U-235 -> Kr-94 + Ba-139 + nøytroner (energi frigjøres)
Fusjon Når vi slår sammen små atomer vil resultatet bli at flere nukleonene samles og energi blir da frigjort. Dette skjer i hydrogenbomber og kanskje i sola.
H-2 + H-3 -> He-4 + nøytron (energi frigjøres)
Om vi sammenlikner atomvekten med antall nukleoner (Protoner+nøytroner) i ulike grunnstoff, får vi ulike forhold for ulike atom. Nå kan vi i tabeller finne massen til elektronet, protonet og nøytronet oppgitt med stor nøyaktighet, og da skulle vi ikke forvente at kjernepartiklene har ulik masse i ulike stoff slik som vi påstår her. Har et proton en fast masse som kan oppgis i en tabell eller har det ikke en fast masse? Dette var ett av de spørsmålene forskerne strevde med rundt århundreskiftet. Det var på denne tiden vi fikk Einsteins berømte likning E=mc². Nå skal vi ikke drøfte denne i dybden, men bare trekke fram det sentrale i denne likningen. Forsøk viser nemlig at ved endringer i atomkjernene så får vi ut energi etter følgende formel:
ΔE= Δm·c²
Det betyr altså at om det skjer en endring i den totale massen ved endring av atomstrukturer, så vil vi få ut en energimengde som er proporsjonal med denne masseendringen. Her er det ikke snakk om at elementærpartikler skapes eller forsvinner, men det er da snakk om at de settes sammen i nye atomstrukturer. Den første formelen, som vi vanligvis ser i bøker, kan da mistolkes som en antydning om at det f.eks. er mulig å fjerne et proton fra universet og at resultatet da blir en energiutsendelse som er proporsjonal med nøytronets masse multiplisert med c2. Dette siste er da ikke ikke bevist selv om noen kanskje vil hevde at det skjer. Her vil vi derfor anbefale å bruke delta-tegnet (Δ) når formelen presenteres i skoleverket for å understreke at det er snakk om en endring av masse/energi og ikke en total nyskaping/forsvinning av energi.
I litteraturen blir denne likningen til Einstein ofte brukt som et argument for at hans antakelser som la grunnlaget for moderne fysikk var rett. Her vil vi bare kort si at denne sammenhengen mellom masse og energi også er en følge av andre modeller som em-modellen og følgelig kan ikke ligningen brukes som et bevis for at klassisk fysikk ikke kan forklare bakgrunnen for energiutviklingen fra f.eks. ei atombombe.


Vi utsettes hele tiden for radioaktiv stråling. Det meste av denne strålingen kan karakteriseres som naturlig. Den stammer altså fra naturen og har ikke noe med menneskelig virksomhet å gjøre. På den andre siden forårsaker medisin og visse former for industri litt radioaktivitet som vi f.eks. kan kalle kunstig. Denne strålingen er enten nyttig eller en bieffekt av noe vi ikke ønsker å unnvære. Nedenfor vil vi se på de ulike strålingskildenes bidrag til gjennomsnittsmenneskets totale strålingsdose. En inndeling av strålingen utfra hvilke kilder den kommer fra, er vanlig.
1) Kosmisk stråling.
Kosmisk
stråling er et fellesnavn på all høyenergistråling
som har sin årsak ute i universet. Denne strålingen blir stort sett stoppet i atmosfæren slik at den ikke slipper ned til jordoverflata. Energien fra kosmisk stråling vil da overføres til annen type stråling som vi da kan måle ved jordoverflata.
Den strålingen som treffer atmosfæren fra universet er foruten gammastråling og røntgenstråling, raske partikler. Av disse er ca. 85% hydrogenkjerner/protoner og 13% heliumkjerner/a-partikler. Disse partiklene omdannes da ofte til annen radioaktiv stråling når de bremses opp i atmosfæren. De partiklene som når jordoverflata er f.eks. protoner, nøytroner, pi-mesoner, my-mesoner, elektroner og fotoner. Intensiteten til den kosmiske strålingen varierer med høyden over havet. Ved ca 1600 m er strålingen det dobbelte av hva den er ved havoverflaten. Vet 5000 meter er strålingen 7 ganger så stor og ved 8600 meter som er maksimal høyde for fly er den kosmiske strålingen ca 40 ganger høgere enn ved havoverflaten. Det var en Jesuittpresten Teidor Wolf som først oppdaget den kosmiske strålingen. I 1910 klatret han opp i Eiffeltårnet og skulle undersøke om den radioaktiv stråling avtok med avstanden fra bakken, og opplevde da det motsatte.
2) Stråling fra jorda
Det er målt mer stråling fra landjorden enn fra sjøen. Det betyr med andre ord at det finnes endel naturlige radioaktive stoffer i grunnen som sender ut stråling: De viktigste av disse er Uran og Thorium samt isotopen Kalium-40. Som tabellen nedenfor viser har naturlige radioaktive stoffer lang halveringstid.
Stoff |
Halv.tid |
Mengde |
U-238 |
4,5 mill. år |
4 ppM |
U-235 |
0,7 mill. år |
|
Th-232 |
14 mill. år |
|
K-40 |
1,3 mill. år |
2,4%*0,00012 |
Nå finnes det store lokale variasjoner. Når det gjelder uran, er gjennomsnitten for Sør-Norge ca 4 ppM (ppM betyr parts (ant atomer) pr million). Bergartene granitt, gneis og permatitt kan inneholde fra 10-40ppM. Svovelrik alunskifer kan inneholde fra 10 til 200 ppM. Sedimenter og kalkstein inneholder derimot fra 1-4 ppM. For at det skal være økonomisk drivverdig å utvinne uran, må innholdet være over 1000 ppM. Thorium finnes overalt, men ikke i store mengder i Norge. Kalium finnes overalt, også i organisk vev og totalt utgjør kalium 2,4 vektprosent av stoffene på jordoverflata. Når vi så vet at 0,012% av dette er den radioaktive K-40 isotopen er dette derfor et stoff som kan bety endel i det totale strålingsmiljøet vårt. Strålingen fra ovennevnte stoff finnes altså over alt på landjorden.
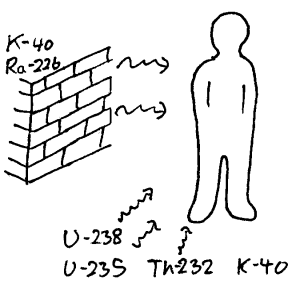
3) Stråling fra bygninger
Bygninger vil i prinsippet beskytte oss litt mot jordstråling. Men til gjengjeld vil mange bygningsmaterialer inneholde radioaktive stoff. Tabellen nedenfor viser becquerel pr kg fordelt på noen bygningsmaterialer og radioaktive stoff.
|
|
Th-232 |
Ra-226 |
K-40 |
Murstein |
63 |
104 |
1040 |
Betong |
37 |
26 |
740 |
Kalk |
4 |
10 |
10 |
Sement |
20 |
30 |
260 |
Generelt vil strålingen innendørs i første etasje være omtrent som ute fordi strålingen her hovedsaklig kommer fra bakken og grunnmuren. I andre etasje i et trehus vil det derimot ofte være mindre stråling enn ute fordi trematerialer er mindre radioaktive enn jord og betong.
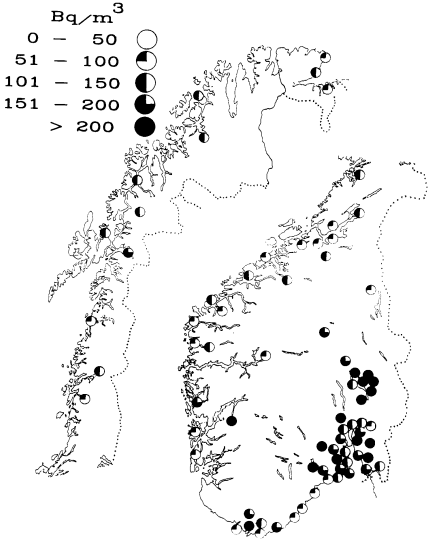
4) Radon
Radon er en edelgass og Rn-222 isotopen er et datterprodukt av U-338. Derfor vil uran i bakken føre til at radioaktiv radon dannes kontinuerlig. Denne gassen vil stige opp fra bakken. Utendørs vil denne gassen bli så uttynnet at den ikke representerer noen stor strålefare. I gruver og andre innelukkede rom i bakken kan derimot konsentrasjonen av radon bli ganske høg. Gruvearbeidere vil derfor ofte få hoveddelen av sin strålingsdose fra radongass og andre radioaktive isotoper som er aktivisert av denne gassen. Et annet problem er at radon kan samles opp i hus fordi moderne hus er relativt tette. Berggrunnen under hus vil alltid inneholde mer eller mindre radon. Denne vil da sive opp gjennom utette kjellergulv. Også vann fra borede brønner kan inneholde relativt mye radon. Figur
er fra Henriksen m.fl.: Radioaktivitet Stråling Helse (Univ.1987 s57).
Tabellen nedenfor viser radiuminnholdet i noen bergarter. Det er da radium som omdannes til radon.
Alunskifer |
700-5000 Bq/kg |
Granitter |
50-300 Bq/kg |
Normal jord |
< 100 Bq/kg |
Nå er det verd å merke seg at radon i seg selv ikke representerer så stor helsefare. Grunnen er at radon er en edelgass som ikke fester seg til organiske stoff. Derimot vil radondøtrene Polonium-218, Bly-214, Bismuth-214 og Polonium-214 representere en helsefare fordi de er metalliske. Det betyr at de kan feste seg til lungevev hvor de så kan avgi stråling. I Norge er det målt ganske høye radonforekomster innendørs i visse områder. Verdens helseorganisasjon (WHO) ha anbefalt mottiltak når radonkonsentrasjonen er høyere enn 800 Bq/kubikkmeter. Mottiltak bør videre vurderes for en konsentrasjon på mellom 200 og 800 Bq/kubikkmeter.

5) Medisinsk bruk av farlig stråling
I kreftbehandling brukes røntgenstråling i forholdsvis stor grad. Videre brukes røntgen også i sammenheng med diagnostikk. Det lages også endel radioaktive isotoper som føres inn kroppen for å kunne "se" hva som foregår her ved hjelp av strålingsfølsomme instrumenter. Nå er røntgenstråling, på samme måte som annen radioaktiv stråling, ioniserende. Derfor regnes den med i den totale strålingsdosen som menneskene utsettes for. Det er imidlertid verd å merke seg at denne strålingen ikke fordeler seg jevnt på menneskene i samfunnet vårt. Derfor regner vi som regel med en slags gjennomsnitt når vi skal avgjøre hvor stor del den medisinske strålingen utgjør av totalstrålingen. Figur
fra Radioaktivitet Stråling Helse (s121)
6) Kjernekraft
Etter at forskerne oppdaget nøytronet, ble det brukt til å lage og identifisere nye isotoper, ved å bombardere ulike kjerner med nøytroner. I 1938 oppdaget fysikerne at uran, som er et
av de tyngste grunnstoffet i naturen, oppførte seg spesielt i forhold til andre atom, når det blir truffet av et nøytron. Det delte seg omtrent på midten. Dette kalles fisjon. Siden de to resultatproduktene var lettere totalt sett, ble det frigjort store mengder energi. Det meste av energien ble frigjort i fisjonsøyeblikket, mens omtrent 7% ble frigjort senere som stråling fra radioaktive produkter. Når det gjelder de radioaktive stoffene som dannes i forbindelse med fisjon, så har mange av dem kort halveringstid. De forsvinner derfor relativt raskt. Noen har imidlertid lang halveringstid, og disse vil da representere en radioaktiv strålingskilde i årevis. Atomkraftverk skaper med andre ord et avfallsproblem. Avfallet fra kjenereaktorer og atombomber kan deles i tre:
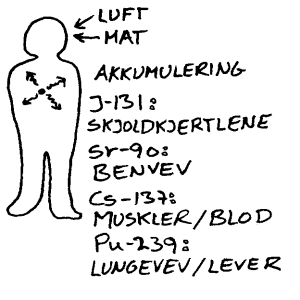
a) Fisjonsprodukter. Urankjernen deles altså i to halvstore atomer som oftest vil være radioaktive. Eksempler på slike stoff er:
|
Halveringstid |
Strontium-90 |
29 år |
Cesium-137 |
30 år |
Krypton-85 |
10 år |
Jod-131 |
8 døgn |
b) Transuranter er tunge atomer som er større enn uran. Disse dannes når store nærliggende uranatomer fanger inn ulike kjernepartikler fra fusjonsprosessen. Disse stoffene vil da som regel sende ut alfa-partikler. Om de kommer inn i kroppen vil de gjøre relativt stor skade. Eksempel på et slikt stoff er Plutonium-239 som dannes når et uranatom fanger inn et nøytron.
c) Aktiveringsprodukter er radioaktive stoff som er dannet fra stabile omliggende stoffer når de treffes av stråling fra fusjonen. Et eksempel er Cobolt-60 som dannes når Cobolt-59 treffes av et nøytron.
Når vi er så opptatt av radioaktiv stråling, har det sammenheng med at den påvirker den menneskelige organismen. I store mengder vet vi at radioaktiv stråling er skadelig. Generelt sier vi ofte at radioaktiv stråling er ioniserende. Det betyr at den kan løsrive elektroner fra molekyl i organismen vår, med den følge at molekylene blir ødelagt. Vi er derfor interessert i å kunne kvantifisere strålingen slik at vi kan si noe mer konkret om hvor farlig det er for mennesker å utsette seg for radioaktiv stråling i ulike sammenhenger. En vanlig enhet i denne sammenhengen er BECQUEREL. Becquerel er definert som antall disintegrasjoner pr sekund. Når det gjelder matvarer er det vanlig å bruke verdien Bq/kg. Når denne verdien er viktig, så har det sammenheng med at mat som spises kommer inn i kroppen, og vi vil da få da strålingskilden på innsiden av huden. α- og β-stråling er mest farlige i kroppen. Som nevnt har disse problemer med å trenge gjennom huden fra utsiden.
Når det gjelder stråling fra eksterne kilder, brukes ofte betegnelsen ABSORBERT DOSE. Denne måles i gray (Gy). Denne er definert som Joule pr. kg. Som nevnt er ikke all stråling like skadelig. Derfor er det innført et begrep som kalles BIOLOGISK VIRKNING som fremkommer om vi multipliserer absorbert dose med en faktor som er ulik for ulike strålingstyper. Vanlig α- og β-stråling samt røntgenstråling har da vanligvis faktor 1 mens gammastråling har faktor 10 eller høyere. Denne faktoren kan vi kalle RBE (relativ biologisk effekt). Enheten for biologisk virkning er Sievert (Sv).

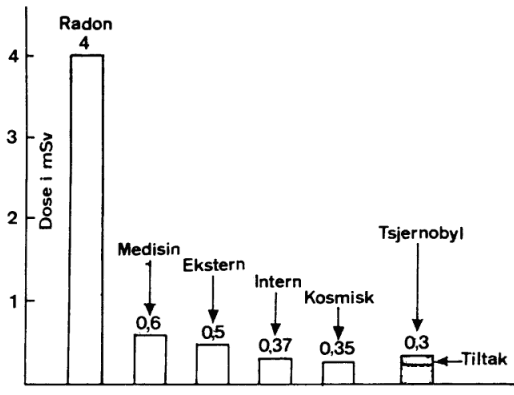
Nedenfor følger en oversikt over hva en gjennomsnittnormann utsettes for av stråling i løpet av et år.
NORMAL BAKGRUNNSTRÅLING
Kosmisk stråling: 0.3 mSv
Bakkestråling: 0.5 mSv
Radongass: 4.0 mSv
NORMAL TILLEGGSTRÅLING
Medisinsk stråling: 0.75 mSv
Yrkesdisponering: 0.002 mSv
Bruksgjenstander:
(Klokke,røykvarsler..) 0.001 mSv
Indre stråling 0.35 mSv
EKSTRA ?
Kjernevåpenprøver,
kjernekraft 1.0 ? mSv
(Kilde Foredrag Bergen Lærerhøgskole 1987, Per Ness)
Generelt kan vi si at en dose på 1 Sv er stor. Når vi ovenfor opererer med mSv kan vi karakterisere dem som små. Strålesyke som ender i dødsfall eller synlige biologiske skader etter stråling, opptrer med langt større doser. I Norge er det ett tilfelle av dødsfall på grunn av stråling. Det var en tekniker som i 1982 ble utsatt for en stråledose på ca. 20 Gy som medførte døden etter 3 uker. Generelt vet vi at stråledoser på over 100 Sv medfører total biokjemisk kollaps etter få timer med døden til følge. En stråledose opp til 100 Sv vil medføre død etter noen dager på grunn av væsketap, infeksjon og indre blødning. En årsak er at tarmepitel, som nydannes hele tiden, blir ødelagt. Ved en stråledose på 1 til 10 Sv vil det skje skader i benmargen der nytt blod dannes. Benmargstransplantasjon kan i visse tilfeller være livreddende.

Positive og negativ virkning av elektromagnetisk stråling
Nå har det vært vanlig å høre at elektromagnetisk stråling som ikke er ioniserende er ufarlig, mens strålingen som er ioniserende er farlig. Her vil vi kort nevne noen observasjoner som antyder at virkeligheten ikke er så enkel. Her vil vi starte med gammastråling, røntgenstråling og UV-stråling som hører med til såkalt ioniserende stråling. Nå er det opplagt at slik stråling er skadelig i store doser. Men hva med mindre doser og smale frekvensband? I artikkelen "Fra strålebiologiens historie" av Johan Baarli i FFV 4/95 kan vi blant annet lese følgende:
For de stråleutsatte fra Hiroshima og Nagasaki som fikk doser lavere enn 100 mGy, viser observasjonene klarere og klarere at dødsraten pr år er lavere fra 50-årsalderen av enn i den alminnelig befolkningen. Den samme tendensen er observert for 1203 kvinner som malte radium på klokkeskiver i England og for 1262 som gjorde det samme i USA. Hos alle disse ble det funnet en overhyppighet av kreft, mens dødsraten av andre grunner var betydelig redusert. For leukemi hos de bombeutsatte i Japan er det påvist omtrent halvparten av forventet forekomst ved doser omkring 80 mGy. Resultatene synes å vise en helsefremmende virkning av den ioniserende strålingen ved slike lave doser.
Allerede i 1955 ble det funnet at en daglig stråledose på 1 mGy til mus økte levetiden fra 684±14 til 783±14 dager. I den senere tid er det funnet at kromosombrudd i blodceller reduseres med en faktor 2 dersom disse på forhånd har fått en liten stråledose. Eksemplene tyder på at ved små doser kan det være en hormonliknende stimulanseffekt (hormese), en positiv påvirkning, til stede.

Noe av det aller viktigste som har skjedd i de senere årene er oppmerksomheten på virkningene av de laveste stråledosene. Disse viser at en biologisk tilpasningsevne og en stråleindusert forsvarsevne mot skader fra ytterligere bestråling, er til stede. Ut fra slike forhold er det ikke å utelukke at små stråledoser kan ha en positiv biologisk betydning. Det synes å gå frem av de mange epidemiologisk data som foreligger, og styrkes ytterligere av strålebiologiske studier.
Når det gjelder lavfrekvent ikke-ioniserende stråling, så har det i senere tid vært endel oppmerksomhet omkring eventuelle skadevirkninger av slik stråling. Skadelige elektromagnetisk felt fra høyspentledninger og mobiltelefoner er eksempler. Generelt kan vi vel si at de lærde strides, men det finnes vel endel undersøkelser som tyder på at det er uheldig å ha barnehager og bolighus i nærheten av høyspentledninger.
Videre er det gjort endel forsøk som tyder på at annen elektromagnetisk stråling kan påvirke kroppen både i positiv og negativ retning. Her vil vi ikke gå inn på disse, men kun si at nerveimpulser er likestrømspulser som følges av en bestemt frekvens. Ulike impulser har da ulike frekvenser. Om elektromagnetisk stråling fra utsiden, interfererer med frekvensen til visse nerveinpulser, kan det tenkes at det oppstå forstyrrelser i det biologiske samspillet i kroppen. Skolemedisinen har ellers hatt problemer med å forklare virkningen av f.eks. akupunktur. Kan f.eks. disse virke som antenner som tilfører kroppen visse frekvenser?

Skriftlige innføringer i atomfysikk starter ofte med å nevne den greske filosofen Demokrit som levde ca. 430 fkr. Han var en av de første som vi vet spekulerte omkring materiens oppbygging. Hans konklusjon var at materien må være oppbygget av noen minste bestanddeler som er udelelige. Disse ble kalt atom som betyr udelelig. Senere har kjemikere vist at det finnes et hundretall ulike atom som materien består av. Disse kalles grunnstoff, og til vanlig vil de også være udelelige hvis vi ser bort fra at atomer lett kan miste og ta opp enkle elektron (ionisering/elektrisitet) og det vi kaller radioaktivitet, som vi skal komme tilbake til. I noen bøker har man tendens til å fremheve oppdagelsen av at atomene kunne deles opp (ved radioaktivitet) så sterkt at mange glemmer at det som vanligvis skjer i naturen er kjemiske forandringer og ikke atomære forandringer. Når stoffer forbrenner eller gjennomgår andre vanlige endringer, så er det altså snakk om at atomene settes sammen på andre måter, men atomene forblir altså uforandret. Overivrige fysikere kan forstyrre elevenes forståelse for dagligdagse kjemiske prosesser om de til stadighet fremhever at Demokrit tok feil. Poenget her er at elever trenger litt ro for å fordøye kjemiprinsippene på samme måte som de trenger ro for å fordøye grammatikkregler ol. Om man for tidlig fokuserer på unntakene fra regelen er det store sjanser for at det ikke skjer en innlæring av grunnprinsippet som gjør at elevene skjønner hva som er hovedregel og unntak.
Ulike grunnstoff oppfører seg da på ulike måter, og dette har da sammenheng med hvordan de er bygd opp. En av fysikernes oppgave var og er vel fortsatt å finne ut hvorfor atomene oppfører seg som de gjør. Kjemikerns oppgave har mer vært å finne ut hvordan vi kan utnytte stoffenes kjemiske egenskaper på måter som er nyttig for oss. Hva består atomene av og hvordan kople de seg sammen i ulike kjemiske stoff slik de gjør? Dette er spørsmål som vi vil konsentrere oss om her. Vi vil i det følgende se litt nærmere på hvilke oppdagelser og forsøk som har gitt oss innblikk i hvordan atomet er oppbygd. Vi vil da ta utgangspunkt i noen kjente forsøk og oppdagelser og se på hva disse har lært oss om atomet. Generelt vil disse oppdagelsene og forsøkene representerte svar på sentrale spørsmål som vitenskapsmenn hadde spurt seg. I vår pedagogiske sammenheng er det viktig å se sammenhengen mellom spørsmål og de svarene som finnes. Om elevene blir overøst med svar på spørsmål de ikke har spurt eller ikke synes er relevante, så er det store sjanser for at de mister interessen. Hvis vi derimot kan få dem til å se paralleller mellom historiens store oppdagelser og deres egen strev med å mestre de nære omgivelsene, så vil sannsynligvis motiveringen kunne vedlikeholdes.

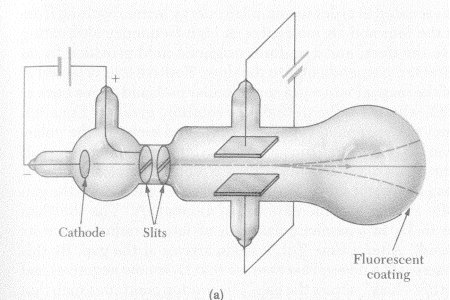

Elektrisitet har vært kjent relativt lenge og Benjamin Franklin (1706-1790) gjorde f.eks. endel systematiske forsøk med statisk elektrisitet som klart viste at det måtte være noe som beveget seg mellom de ulike gjenstandene og han innførte da begrepene positiv og negativ ladning. Ordet elektron er videre det vanlige navnet på de negative ladningene som beveger seg når vi har strøm, og dette har altså vært kjent lenge. Det er likevel engelskmannen Joseph John Thomson (1856-1940) som har fått æren for å ha oppdaget elektronet som den første elementærpartikkelen som er oppdaget. Dette skjedde da han i vakuumrør studerte en elektronstrøm. Ved å utsette denne for elektriske og magnetiske felt klarte han også å beregne forholdet mellom massen og ladningen til elektronet. Forsøket viste altså klart at elektron var små partikler som kunne bevege seg relativt fritt i vakuum. Det var så videre Robert Millican (1868-1953) som først klarte å beregne ladningen til et elektron ved hjelp av sitt berømte oljedråpeforsøk i 1909 og dermed viste man både massen og ladningen til et elektron. Det var videre klart at elektroner var noe som befant seg i atomene til vanlig, og i disse atomene måtte det da finnes noe positivt som nøytraliserte de negative elektronene. Thomson selv foreslo at elektronene var små og hadde en romlig fordeling i atomene omtrent som rosiner i en pudding (Thomsons puddingmodell). Selve puddingen hadde da positiv ladning og var selve atomet.
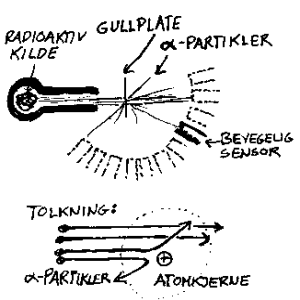
I 1895 hadde Röngten oppdaget at visse stoff kunne utsende visse typer stråling og dette arbeidet så Ernst Rutherford (1871-1937) videre med. I 1911 gjorde han så et forsøk som ble tolket som et bevis for at Thomsons puddingmodell var feil. Selv om forskerne hadde oppdaget at atomet kunne sende ut stråling, og delvis endre seg som følge av dette, visste de lite om hvordan atomet var oppbygget. Hvordan var de ulike delene i atomet "limt" sammen og hvor store var de ulike delene? Ernst Rutherford fikk ideen om å sende de positive partiklene som kom fra et radioaktivt stoff (α-partikler) gjennom et tynne stoff og se hvor mange som ble reflektert. Han brukte et radioaktivt stoff som kilde og styrte så α-partikler mot ei tynn gullplate. Rutherford hadde beregnet hvor mange atomer det var i gullplata. Rutherford antok videre at de positive partiklene ville kollidere elastisk mot de positive atomene og spredningen av partikler etter kollisjonen skulle da avdekke hvor stort hvert gullatom var. Rutherford forventet altså at noen av α-partiklene skulle treffe gullatom og noen skulle treffe mellom dem. Siden det var tilfeldig hvor α-partiklene traff, ville forholdet mellom antall partikler som traff noe hardt og ble avbøyet, og de som ikke ble avbøyet, fortelle noe om hvor store atomene var. Den store overraskelsen var at det var svært få α-partikler som ble avbøyet. De fleste gikk altså rett gjennom gullplata. Generelle beregninger tilsier at avstanden mellom atomene (fra sentrum til sentrum) var i størrelsesorden 10-10 meter. Antall α-partikler som i forsøket traff noe hardt og ble avbøyet tilsa imidlertid at det positive i atomene var i størrelsorden 10-14 meter. Rutherford tolket da dette forsøket dit hen at atomene hadde en liten men tung kjerne som var i størrelsorden 10-14 meter. Rutherford innførte derfor begrepet atomkjerne. Ifølge moderne fysikk er da kjernen en avgrenset del av atomene som inneholder de positive ladningene som vi kaller protoner og nøytroner.
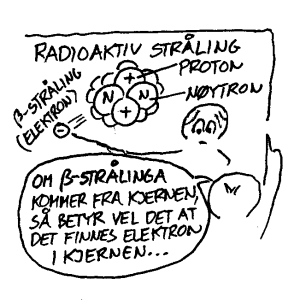
Det er sjelden at lærebøkene forteller noe om hvordan man oppdaget den elementærpartikkelen som kalles nøytron, men i PSE(p1344) kan vi lese at den ble oppdaget av Chadwick i 1932. Ifølge vanlige lærebøker er dette da en nøytral partikkel som befinner seg i kjernen sammen med protonene og den har da omtrent samme masse. Siden vi her mangler nærmere beskrivelser av forsøk som beviser eksistens av såkalte nøytroner, vil vi i stedet trekke inn et kjent fenomen som involverer nøytroner. C-14 er en radioaktiv karbonisotop som kjemisk oppfører seg som vanlig karbon (C-12 og C-13). Når ulike atom oppfører seg likt kjemisk så har det sammenheng med at det har like mange elektroner som er aktive i kjemiske bindinger. For at disse skal være nøytrale antar man så at det er like mange protoner i kjernen. Når det gjelder karbon er det snakk om 6 elektron og 6 proton. I tillegg vil det så ifølge lærebøkene finnes 6, 7 eller 8 nøytroner i kjernen avhengig av hvilke isotop det er snakk om. Et C-14 atom er imidlertid radioaktivt og det betyr at det før eller siden vil kunne omdannes til et N-14 atom som da er den vanligste nitrogenisotopen i naturen. Når dette skjer vil det sendes ut et elektron med høy energi/hastighet og dette kalles β-stråling. Det totale regnskapet er da at et nøytron blir omdannet til et proton som forblir i atomet og et elektron som forlater atomet. Et nærliggende spørsmål er da om ikke nøytronet egentlig alltid har vært et proton og et elektron. Nå er det i og for seg ikke noe i vegen for å kalle et slikt par for et nøytron, men i pedagogisk sammenheng bør man vel søke etter de enkleste forklaringen som vanligvis gir mest forståelse.
Før vi går videre å ser på kreftene som virker i og mellom atomene så vil vi også nevne noen andre grunnleggende oppdagelser som viste at atomene ikke var så stabile som man først trodde.
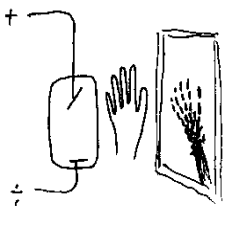
Den 8. november i 1895 arbeidet Wilhelm Conrad Röntgten med elektriske utladningsrør (Crookers' rør) som er et enkelt evakuert glassrør med en anode og en katode. Det som kjennetegner dette røret er da at endel elektroner treffer glassveggen hvor de da avgir røntgenstråling. Grunnen til at elektroner treffer glassveggen med stor fart er da følgende: Positive ioner i den fortynnede gassen blir tiltrukket av den negative katoden og når de treffer katoden blir negative elektroner slått løs. Disse ble så i sin tur tiltrukket av den positive anoden, men på grunn av fysiske forhold bommer endel av disse på katoden og treffer veggen i stedet.
I dette spesiell tilfellet hadde Röntgen lagt sort papir over røret. Da oppdaget han tilfeldig at en fluoreserende skjerm som var plassert noen meter fra røret begynte å lyse. Han sluttet da at det måtte komme stråling fra røret som trengte gjennom papiret. Han startet så et program hvor han undersøkte hva strålingen kunne trenge gjennom. Det oppsiktsvekkende var da at strålingen trengte gjennom det meste i større eller mindre grad. Et av de første røntgenbildene var av konas hånd, og det viste da at knoklene stopper disse strålene i større grad enn vanlig cellevev. Det er da dette som er grunnlaget for kontrasten i røntgenbilder. Röntgen fant videre at denne strålingen ikke lot seg avbøye av magneter, og han skjønte derfor at den ikke bestod av ladde partikler.
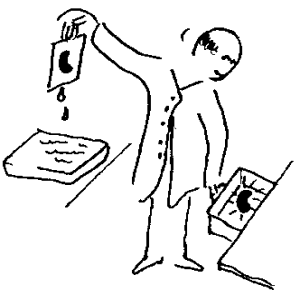
Allerede året etter oppdagingen av røntgenstråling oppdaget ble radioaktiviteten oppdaget av franskmannen Antoine Henri Becquerel. Han studerte blant annet fluoreserende stoff. Dette er stoff som vil sende ut lys når de blir tilført energi på ulike måter. I dag kan vi finne slike stoff i TV-skjermer, lysstoffrør ol. Ved en tilfeldighet ble en fotografisk plate liggende sammen med et urankrystall i ei skuff. Da platen senere ble fremkalt viste det seg at den var svertet. Den hadde med andre ord blitt utsatt for stråling som bare kunne komme fra urankrystallet. Dette måtte bety at uranet sendte ut en form for stråling som liknet på røntgenstråling. Becquerel tenke videre at det var noe med selve atomene som gjorde at uran sendte ut stråling. Den strålingen som kommer fra radioaktive stoff består blant annet av gammastråling som er elektromagnetisk stråling på samme måte som røntgenstråling, men gammastrålingen har da høyere frekvens.
Problemer
Det spesielle ved den nye strålingen som ble oppdaget, var dens gjennomtrengingsevne. Mange satte i gang å forske på denne nye strålingen, og mange av disse opplevde da alvorlige hudforbrenninger. De kunne få skader som håravfall og tildels store sår etter en tid. Først trodde man at det var innslag av ultrafiolett lys som forårsaket skadene, men etterhvert ble det klart at det var de nye strålene som forårsaket skadene. Vi vil komme tilbake til skadevirkninger av radioaktiv stråling senere i heftet.
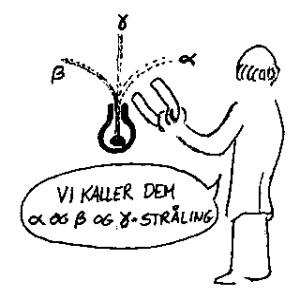
Atomet kan deles
Senere fant forskere flere stoff som sendte ut stråling. Disse er senere blitt kalt radioaktive stoff. Den britiske forskeren Ernst Rutherford prøvde på sin side å kartlegge hva den aktuelle strålingen bestod i. Ved å la strålene fra et radioaktivt stoff gå gjennom et magnetfelt viste det seg at noe av strålen ble avbøyet. Vi vet at ladninger blir avbøyet når de beveger seg gjennom et magnetfelt (eks TV). Rutherfords konklusjon var da at noe stråling bestod av positive ladninger og noe stråling bestod av negative ladninger. Den strålingen som bestod av positive ladninger kalte han α-stråling (alfa) og den strålingen som bestod av negative ladninger kalte han β-stråling (beta). Forsøk viste også at det var en stråling som ikke ble avbøyet av magnetfeltet. Denne strålingen ble senere kalt
γ-stråling (gamma). Det ble også påvist at det ble dannet nye stoff ved radioaktivitet. Selve a-strålingen viste seg å være heliumkjerner som siden ble til helium. Uran var et vanlig stoff i de radioaktive kildene som ble brukt. Et resultat av radioaktiviteten var at det ble dannet bly. Dette ble da tolket slik at uran ble til bly når det sendte ut radioaktiv stråling.
Disse observasjonene var da de avgjørende bevisene for at atomene ikke var udelelige. Den strålingen som var observert kom altså fra atomene selv. Når noe ble borte fra et atom fikk vi dannet nye atom. Derfor regner vi ikke lenger atomet som udelelig. Når det gjelder spørsmålet om hva som finnes i atomet, så er det nærliggende å si at det som kan komme ut fra atomet en gang må ha vært inni atomet. a-partiklene viste seg å være en ny type atom, nemlig helium (He). Dette tilsier at alle atom er bygd opp av noe som de kan ha mer eller mindre av. β-partiklene viste seg å være vanlige negative elektron, som var kjent fra tidligere eksperiment med f.eks. utladningsrør. En konklusjon i denne sammenhengen er da at atomene også består av elektroner.
Det store spørsmålet omkring 1900 var spørsmålet om hva slags krefter som holdt elementærpartiklene på plass i atomene og hva slags krefter som holdt atomene sammen i ulike molekylstrukturer. Etter at man har påvist hva atomene består av, så må man også kunne sannsynliggjøre at atomene virkelig er satt sammen slik vi tror. Fra elekrisitetslæren vet vi at like ladninger fraskyver hverandre og ulike ladninger tiltrekker hverandre. Hvis atomet så består av mange nærliggende positive og negative ladninger vil det være sterke elektriske krefter mellom disse og for at disse kreftene ikke skal føre til at atomet klapper sammen eller sprenges, så må atomene også inneholder andre krefter som kan holde partiklene på plass.

Det var Rutherford som først foreslo at de positive protonene befinner seg i en liten kjerne. Siden positive ladninger vil fraskyve hverandre trenges det i praksis krefter som kan motvirke de elektriske fraskyvingskreftene, men litteraturen forteller ikke at han hadde noe løsning på dette problemet. Det andre problemet som Rutherford stod overfor var at den elektriske tiltrekningskraften ville trekke negative elektronene inn mot den positive kjernene. I den sammenhengen hadde han et forslag til hva som holdt elektronene på plass i passende avstand fra kjernen. Han foreslo at elektronene gikk i sirkelbane rundt kjernen som planetene går i sirkelbane rundt sola. Når det gjelder planetene så er det "sentrifugalkraften" (egentlig treghet) som hindrer dem i å ramle ned på sola som da trekker på planetene med en gravitasjonskraft. Rutherford visste imidlertid at denne forklaringen ikke var god. Grunnen er at ekektromagnetismen forteller at et elektron som går i sirkelbane vil være akselerert og vil følgelig sende ut elektromagnetisk stråling og dermed miste energi. Elektronene i et atom sender til vanlig ikke ut elektromagnetisk stråling. Det var derfor behov for et bedre alternativ, men Rutherford hadde ikke det.
Fysikerne hadde problemer med å forstå atomet og her følger et sitat fra ei lærebok i fysikk: Now the stage was set for Bohr! In order to circumvent the deduction of electrons falling into the nucleus and continuos emission spectrum from elements, Bohr simply postulated that classical radiation theory did not hold for atomic sized systems. He overcame the problem of a classical electron that continually lost energy by applying Planck's idea of quantized energy levels to orbiting atomic electrons. (PSEp1214)
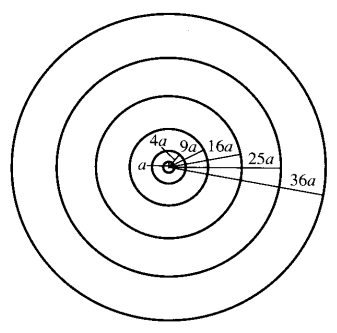
Sirklene i figuren til høyre viser kuleskall eller elektronbaner i det atomet som Bohr foreslo. Generelt kan vi si at Bohrs begrunnelse for at de positive elektronene ikke falt inn i den positive kjernen var at han antok at vanlig fysiske lovmessigheter ikke gjaldt i atomene. Han fant altså ikke fram til et nytt prinsipp som forklarte atomets oppbygging, men han viste derimot at hvis man antok at elektronene befant seg i bestemte kuleskall omkring atomkjernen, og hvis man antok at de utvekslet lys eller fotoner med omgivelsene når de hoppet fra et kuleskall til et annet, så kunne man matematisk vise at de aktuelle energiforskjellene kunne passe med det spektralmønsteret man observerte fra hydrogen.
Although these successes were important to scientists, it is perhaps even more important that the Bohr theory gave us a model of what the atom looks like and how it behaves. (PSEp1214)
Dette sitatet forteller videre at Bohr gav oss et bilde av hvordan atomet 'ser ut og hvordan det oppfører seg'. Nå kan man diskutere om det "atombildet" Bohr etterlot seg og som man finner gjengitt på ulike måter i ulike lærebøker virkelig gir et forståelig bilde av hvordan atomet ser ut. Det mange likevel ikke er klar over er at Bohrs atommodell i dag er forlatt av vanlige fysikere. Det viste seg nemlig at den kunne forklare svært lite av det vi observere og i dag er den erstattet av en ren matematisk kvantemodell. Grunnen til at Bohrs atommodell fortsatt henger igjen i lærebøker selv om den er forlatt i praktisk fysikk, har sammenheng med at de rene matematiske modellene som har avløst Bohrs atommodell er enda vanskelige å anskueliggjøre ved hjelp av bilder eller figurer. Når Bohr ofte nevnes som en grunnlegger av kvantefysikken, så er ikke grunnen først og fremst hans vitenskapelige innspill er blitt spesielt nyttig i ettertid, men det er vel mer fordi han var en av de som våget å bryte med datidens etablerte vitenskapelige tankemønster. I Columbia Encyclopedia som ligger på internett (http://www.bartleby.com/65/li/light.html) kan man f.eks. lese:
With the development of the quantum theory of atomic and molecular structure by Niels Bohr and others, it became apparent that light and other forms of electromagnetic radiation are emitted and absorbed in connection with energy transitions of the particles of the substance radiating or absorbing the light. In these processes, the quantum, or particle, nature of light is more important than its wave nature.
I praksis valgte Bohr å se bort fra blant annet bølgeegenskapene i lyset og andre etablerte lovmessigheter innenfor elektromagnetismen. Han valgte i stedet å anta at lys var kvantisert i såkalte fotoner som da er adskilte energipakker som i atomsammenheng likner mer på partikler enn på bølger.
I ettertid kan vi vel si at fotoelektrisk effekt er blitt det mest kjente forsøket som da støttet denne antakelsen.
Mens Bohr etter manges mening var en viktig grunnlegger av kvantefysikken, så kan man vel si at Einstein var den sentrale grunnleggeren av relativitetsteoriene. På samme måte som Bohr valgte å se bort fra etablerte lovmessigheter innenfor klassisk fysikk når han skulle beskrive atomet, kan vi si at dette også er karakteristisk for Einstein. Relativitetsteoriene fremstod, på samme måten som kvanteteorien, som et alternativ til datidens etablerte vitenskap. I stedet for å bruke tid på å beskrive relativitetsteoriene vil vi her kort nevne hva Einstein argumenterte mot. Omkring 1900 hadde vitenskapen gjort store framskritt når det gjaldt å forstå fenomenet lys. Man hadde konstatert at lys var elektromagnetiske bølger, og det var da en selvfølge at man antok at lysbølgene trengte et medium å bevege seg i. Dette mediet ble kalt eter, og man strevde da med å prøve å forstå de fysiske egenskapene ved denne eteren. På den samme nettsiden kan vi også lese:
Einsteins svar på diskusjonen om eterens natur var da rett og slett å anta at den ikke eksisterte. Her vil vi ikke gå inn på alle konsekvensene av denne antakelsen men bare sitere et annet nettsted (http://planetquest.jpl.nasa.gov/SIM/michelson.html) tilknyttet den amerikanske romfartsorganisasjonen NASA:
The surprising result of this experiment, and it has since been repeated over and over again with very high accuracy, is that there is no measurable motion of the Earth relative to the ether. This result left physicists stunned for many years and some of them postulated that the ether, while real, was in principle unobservable. Albert Einstein finally took a brave step forward with the publication of his theory of special relativity in 1906. His apparently innocent and reasonable argument was that, if the ether was unobservable, or in other words that there was no experimental proof of it whatsoever, the simplest explanation was that it did not exist.
The surprising consequence of this innocent statement was however, that time itself did pass at different rates along the two paths of Michelson's interferometer. It was this stunning consequence that took scientists years to accept and only in light of the overwhelming experimental proof did they accept as fact what seemingly runs against all intuition.
Einsteins teori representerte med andre ord et radikalt brudd med datidens vitenskapelige tankemønster. Det å anta at det ikke fantes en eter fikk da ikke bare konsekvenser for hvordan man skulle forstå lysfenomen, men det fikk da også konsekvenser for hvordan man oppfattet grunnbegrep som tid og rom.
Som sitatet ovenfor antyder er det så interferensforsøket til Michelson og Morley, som blir betraktet som det viktigste argumentet for at Einsteins alternative forklaringsmodell var rett.
Når man beskriver naturen matematisk finner man ofte likheter og sammenhenger mellom ulike naturbeskrivelser. Et eksempel er Maxwells matematiske påvisning av at elektrisitet, magnetisme og lys måtte være beslektede fenomen. Slike sammenhenger blir da ofte tolket som en tegn på at man er i ferd med å nærme seg en mer grunnleggende forståelse for naturen. Sannsynligvis var det slike tanker som lå bak da Louis de Broglie foreslo at hvis lys har partikkelegenskaper, så bør også partikler ha bølgeegenskaper. I Columbia Encyclopedia kan vi da lese:
When the transmission of light is under consideration, however, the wave nature dominates over the particle nature. In 1924, Louis de Broglie showed that an analogous picture holds for particle behavior, with moving particles having certain wavelike properties that govern their motion, so that there exists a complementarity between particles and waves known as particle-wave duality.
Elektronspredningsforsøk er da regnet som avgjørende bevis for at elektronet har bølgenatur.
Før vi ser nærmere på de tre forsøkene som er nevnt her vil vi gi en kort kommentar til de tre forsøkene som mange mener beviser at moderne fysikk er rett. Nå er det ikke vanskelig å finne lærebøker som lovpriser grunnleggerne av moderne fysikk. Her følger et eksempel.
"Det er viktig å være klar over at det ikke bare var små nye fysikkproblem som ble løst i denne perioden, men et helt nytt syn på naturlovene vokste fram. I denne tiden trengte man ikke bare nye formler, men en ny filosofi og et nytt verdensbilde som var utenfor rekkevidde av fornuften, men ikke utenfor eksperimentell rekkevidde. Bohr sin rolle i fysikkens og filosofiens smiearbeide i dette århundre var enorm." (GPp611, min oversettelse)

Ovennevnte sitat viser vel at Bohrs bidrag til å forstå atomet var at han innførte en slags ny filosofi hvor man ikke lenger var avhengig av fornuften, og det er da forståelig at mange var skeptiske til en slik filosofi. Om vi kutter ut fornuften, hva har vi da igjen som kan hjelpe oss med å vurdere om noe er bra eller dårlig? Om vi tenker på klassisk fysikk som et byggverk, så kan vi si at den hviler på en visse grunnprinsipp og i denne sammenhengen kan man vel si at såkalt "sunn fornuft" er et viktig element i grunnmuren til klassisk fysikk.
Da moderne fysikk ble grunnlagt kan vi si at man hadde et halvferdig klassisk byggverk og ikke noe alternativ. Bidraget fra grunnleggerne av kvantefysikken var da at de skisserte et alternativ bygg bygd på en annen grunnmur (andre grunnprinsipp). Men her er det verd å merke seg at de som argumenterte for dette alternative byggverket hadde lite konkret å vise til den gangen. På en måte solgte de et "luftslott" fordi de det den gangen ikke hadde et ferdig byggverk å vise til. Hovedargumentet for det nye bygget var altså ikke at dette bygget hadde konkrete fortrinn, men at det fantes problemer i det gamle klassiske bygget. Det tre forsøkene (Interferensforsøket, Fotoelektrisk effekt og elektronets partikkelnatur) ble da brukt som bevis for at det klassiske byggverket ikke holdt mål og det har da i ettertid ført til at flertallet av dagens forskere har forlatt det klassiske huset. Men det finnes da fortsatt endel som foretrekker klassisk fysikk og som da også mener at de aktuelle forsøkene ikke er noe bevis for at klassisk fysikk er feil.

Problemet i denne sammenheng er da om det nåværende byggverket til moderne fysikk er av en slik nature at det er mulig å påvise interne problemer slik at man eventuelt kan gå tilbake til det andre byggverket om dette viser seg å være bedre. Generelt kan vi si at det klassisk bygget hadde en grunnmur med klare logiske prinsipp som i neste omgang kunne brukes for å påvise og rette på skjevheter lenger oppe. Det var så dette som kritikerne av klassiske fysikk nyttet seg av når de fikk folk med over til det andre bygget. Spørsmålet er da om det finnes en tilsvarende grunnmur i det nye byggverket til moderne fysikk? Hva slags type forsøk må man f.eks. vise for å kunne falsifisere moderne fysikk? Her vil vi ikke bruke mer tid på dette, men bare nevne et annet bilde fra dagliglivet. Kan man f.eks. tenke seg at de som aksepterte kvantefysikken trodde at gresset var grønnere på andre siden av et gjerdet fordi man så noen mindre svarte flekker på egen side. Når de så hoppet over gjerdet viste det seg at de havnet i et "gjørmehull" uten fast grunn å bygge noe som helst på. Ikke en gang et stillas for å komme seg tilbake. Om dette er en rett karakteristikk av moderne fysikk, så må det vel bety at de som tror på grunnprinsippene i denne teorien (hva de nå enn må være) ikke på egen hånd vil være i stand til å innse at egen modell har alvorlige svakheter. Kanskje trenges det da en ny generasjon av forskere som er vokst opp på andre siden, før man får vitenskapen ut av denne "hengemyra".
Hvordan forklare spektalmønster?
Det kanskje viktigste argumentet for kvantemodellen i dag er at den til en
viss grad kan forutsi og forklare de ulike spektralmønstrene vi oppservere fra
ulike stoff. En alternativ atommodell må da også kunne forklare slike spektralmønster.
Det lyset som omgir oss kommer fra en lyskilde og vi sier da at en lyskilde emitterer lys. Før eller siden vil lyset treffe noe som da tar opp eller absorberer energien i lyset slik at lyset forsvinner. Dette kalles absorpsjon, og til vanlig blir lyset da omdannet til varme. Generelt skiller vi også mellom primærlys og sekundærlys (spredt eller reflektert lys). Sola, stjerner, glødetråder i lyspærer, TV-skjerm gir primærlys mens månen, planeter, skyer, matte lampeskjermer, lyse vegger, OH-skjermen og det meste andre vi ser vil da gi sekundærlys. Her følger videre noen ord som brukes i forbindelse med emisjon av lys og det er da nyttig for en lærer å kjenne til disse.
Luminisens = kalde/ikke-glødende stoff sender ut lys (fellesbegrep)
Fluorescens = momentant opphør i lysutsendelse når tilført energi stopper (TV-skjerm ol)
Fosforescens = fortsette lysutsendelse en stund (selvlysende felt på vekkerklokke, ..)
Fotoluminescens = absorbert lys sendes ut med lavere frekvens ("selvlysende" orangrøde sikkerhetsklær)
Demonstrasjon av: Fosforesens

Refleksjon, spredning eller absorpsjon/emisjon
Når vi ser ting omkring oss så er årsaken at det som omgir oss sender lys som treffer øynene våre. Hvis det er totalt mørkt omkring oss, så vil vi ikke se omgivelsene fordi det vi omgir oss med ikke sender ut lys av seg selv. Dette forteller oss da at lyset fra sola eller andre lyskilder på en eller annen måte blir til lys som gjenstandene omkring oss sender mot oss. Men hva skal vi kalle det som skjer i det vi ser som gjør at vi ser det? Hva bør vi som lærere si om det som skjer i f.eks. et gult ark som er årsaken til at vi ser det.
Feil 1: Det er vel mest vanlig å si at et gult ark reflekterer gult lys og absorberer andre farger. Tidligere har vi nevnt at refleksjon er noe som skjer i ei plan overflate. Å bruke ordet refleksjon i dette tilfellet er uheldig fordi det her ikke er snakk om vanlig refleksjon.
Feil 2: De som har hørt om kvantefysikken vil ofte si at arket absorberer alle fargene men tilbakesender (emitterer) gult lys. Energien i innfallende lys vil overføres til elektroner som eksiteres (absorberer energi) og så vil noen elektroner hoppe tilbake og sende ut igjen gult lys. Dette er da en vanlig antakelse blant de som har hørt kvantefysikkforklaringer av lys. Generelt har kvantefysikken fått stor plass i dagens lærebøker på tross av at det er en teori som kan forklare svært lite av det vi ser omkring oss til daglig. Kvanteforklaringer kan altså ikke brukes i dette tilfellet. Når arket ser gult ut, så er det ikke fordi det finnes relativt mange elektroner i arket som hopper opp og ned mellom to energitilstander som svarer til gult lys.
Rett: Den beste måten å forklarer hvorfor vi får tilbake mest gult lys fra et gult ark er da å si at arket absorberer minst av det gule lyset. Dette gule lyset når lengst inn i arket og her blir det da bøyd eller spredt i alle retninger i nærheten av atomene. Noe av dette lyset blir da så mye avbyet eller spredt at det kommer ut igjen på samme siden som det gikk inn. Er arket tynt vil vi da også se at endel av det gule lyset går ut på baksiden.
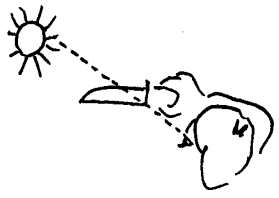
Lys går ikke alltid i rette linjer!
På samme måten som kvanteforklaringer kan føre tanken inn på uheldige spor når vi forsøker å forstå lysfenomen, kan også påstanden om at lys går i rette linjer gjøre det samme. Det er altså ikke sant at lys går i rette linjer fordi det finnes mange eksempler på at lys ikke går i rette linjer. Når vi skal forklare fargespekter fra gitter må man for eksempel anta at lysstrålene bøyes ut til sidene når de går gjennom en spalt og denne bøyingen blir mer fremtredende jo smalere spalten blir. Det er mulig å demonstrere det med å sende laserlys gjennom en smal spalt mellom to barberblad eller liknende. En annen måte å observere at lys bøyes er å holde en kniv foran sola slik figuren viser. Man vil da se at noe av sollyset bøyes ned bak knivbladet selv om øyet befinner seg i skyggen. NB! Ikke se direkte på sola. Det lille mengden
med lys som bøyes ned bak knivbladet er derimot ikke skadelig.
Når lys går inn mellom atomene i et stoff svarer det til at lys møter mange smale "spalter" og det vil da bøyes litt i to retninger. Når lys treffer hvitt papir, skyer, snø eller melk vil lyset bøyes i alle retninger inne mellom atomene og dette kaller vi da spredning. I slike hvite stoff skjer det da lite absorpsjon. Det lyset som treffer hvite flater har ofte tilnærmet samme retning fordi det kommer fra en lyskilde, mens det lyset som kommer ut igjen fra hvite stoff er spredt i alle mulig retninger. Det er spredt og derav ordet spredning
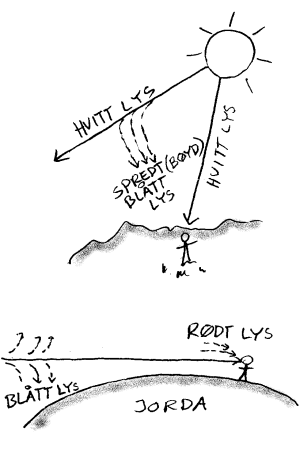

Hvorfor er himmelen blå?
De fleste har vel møtt dette og tilsvarende spørsmål i samvær med barn, og det er da viktig at vi kan svare barna når de spør. Slike spørsmål tyder på at de er motivert for å lære, og en lærer som må svare 'vet ikke' på slike spørsmål vil bidra til å dempe motivasjon og dempe den naturlig nysgjerrigheten hos barn. Når det gjelder det ovennevnte spørsmålet vil trenger er svaret at hvitt lys fra sola inneholder alle farger. Når så dette hvite lyset treffer luften omkring jorda så vil det blå lyset sprees eller bøyes mer enn de andre fargene. Det vil med andre ord si at når vi ser den blå himmelen så ser vi egentlig blå solstråler som er bøyd i luften slik at de treffer øyet vårt. Om noen så spør om hvorfor himmelen og sola blir rød når den står lavt på himmelen så har det sin årsak i den samme spredningen. Når sola står lavt på himmelen må sollyset gå gjennom mye atmosfære/luft for å nå oss og i denne luften så har da den blå delen av sollyset blitt spredt ut i alle retninger. Det røde lyset blir derimot spredt minst i atmosfæren og derfor er det mest rødt lys som når fram til øyet vårt. Derfor ser sola rød ut. Morgen og kveld ser himmelen rød ut fordi luft også sprer rødt lys men da i mindre grad enn blått lys. Det blå lyset sprees derfor bort før det røde lyset.
Om noen spør om hvorfor gress og blader er grønne, så er dette et spørsmål som kan besvares på ulike måter. Det mest grunnleggende svaret er vel å si at bladene absorberer de andre fargene (særlig rødt og blått) mens det grønne lyset blir spredt tilbake uten noe særlig tap å¨grunn av absorpsjon.
En modell som illustrerer absorpsjon og emisjon
Noen elever tenker mer enn andre og det er da viktig at læreren også kan hjelpe de som er flinkest. I praksis er det vanskelig å gi dem "spesialundervisning" på et nivå som resten av klassen ikke skjønner, men det er mulig å hjelpe dem i gang med en prosess hvor de selv kan finne svar på ulike spørsmål. I denne sammenhengen er det viktig med gode modeller. Tidligere har vi antydet at kvantemodellen er en modell som forvirrer mer enn den oppklarer, og her vil vi da kort nevne en alternativ modell. Før eller siden vil det dukke opp et spørsmål om hva som skjer med det røde og blå lyset som blir absorbert i et blad eller en annen grønn flater. Det er generell enighet om at det er elektroner i stoffet som fanger opp energien i lys når det skjer en absorpsjon, men hvordan skjer det i praksis?
Til høyre har vi vist de såkalte Burmesiske bjellene som blant annet brukes i illusjonsnummer hvor noe prøver å overbevise andre om at de er i besittelse av overnaturlige evner. Bjellene er i praksis pendler med ulike lengder som henger fra en stang. Her foreslår vi da å farge de ulike pendlene slik at den lengste pendelen er rød og den korteste fiolett (ev. blå). Både når det gjelder lys og pendler er det snakk om frekvens og svingetid. Sammenhengen er da at en lang pendel gir lavere frekvens enn kortere pendler og rød lys betyr lavere frekvens enn fiolett lys. I figuren til venstre har vi 4 pendler (rød, gul, grønn og blå) og disse kan da brukes som bilde på ulike elektroner. Elektronene kan på samme måten som pendlene svinge/vibrere litt fram og tilbake og jo nærmere elektronene befinner seg til kjernen (stanga), jo høyere egenfrekvens vil de ha. En pendel med en bestemt lengde vil alltid svinge med en bestemt frekvens og det er da denne frekvensen som vi her kaller egenfrekvensen.
Når elektroner svinger fram og tilbake vil de sende ut lys. Når sola og andre lyskilder sender ut lys med et kontinuerlig spekter så betyr det at det i overflaten finnes elektroner som svinger med alle typer frekvenser. En slik svingning fram og tilbake vil da medføre at det emitteres lys og elektronene vil da miste energi. Når vi tilfører energi til noen stoff (salt, glass ol.) kan vi observere at de sende ut lys med bare noen utvalgte frekvenser. Årsaken til dette er da at det er bestemte elektron med bestemte egenfrekvenser som svinger og disse vil da bare sende ut lys med den egenfrekvensen som de har selv.
Når elektroner treffes av lys vil de begynne å svinge. Om vi tenker på hvitt lys som treffer en gul flate så kan vi tenke oss at denne inneholder ulike elektroner. Årsaken til gulfargen er da at få elektroner har egenfrekvensen som svarer til gult lys. Vi kan illustrere dette ved å fjerne den gule pendelen. De andre pendlene vil da absorbere sine farger og svinge med, men det gule lyset i sollyset vil da ikke finne noen elektroner som kan fange opp den aktuelle frekvensen. Det aktuelle lyset vil da avbøyes eller sprees tilbake slik at arket ser gult ut.
Et elektron som begynner å svinge vil selv begynne å stråle ut energi, og i utgangspunktet skulle man kanskje tro at de sender ut samme lyset som de mottar. Her vil vi da kort nevne to forhold som kan forklare hvorfor ikke lyset blir emittert i like stor grad som det blir absorbert. Et elektron som absorberer lys fra en retning vil emmitere lys i alle retninger. Om vi da antar at det skjer små energitap når energi overføres fra lys til elektronsvingninger og omvendt så vil dette kunne forklarer hvorfor noe lys forsvinner.
Et annet forhold kan illustrere om vi gjør stanga som holder pendlene ustabil (balanserer den på en spiss eller henger den i andre tau). Vi vil da se at svingninger i de ulike pendlene vil påvirke hverandre og resultatet kan da bli svingninger med andre frekvenser. Når det gjelder lys så sier vi at lysenergi blir omdannet til varme når lys treffer en mørk flate. Varme er da nettopp svingninger med en annen (lavere) frekvens enn lys.