En bedre modell som forklarer naturen?
(Ikke ferdig)
Forståelse er målet for en forklaringsmodell
 For
at man skal forstå naturen trenger man en modell av naturens byggesteiner; atomene.
Ifølge tradisjonelle lærebøker består atomene av en positiv kjerne og elektroner
som går i bane rundt omtrent slik som figuren til høyre antyder. (Den er hentet
fra en nettside). Bakgrunnen for at elektronene beveger seg rundt kjernen var
at man trengte en mekanisme som hindret de negative elektronene å bli trukket
helt inn i kjernen. I dag er vel alle enige om at denne atommodellen
er dårlig, men begrunnelsen for å bruke den er da at man ikke har noe bedre.
I tillegg til at denne atommodellen viser ting som vi positivt vet må være
feil, så gir den heller ikke svar på endel spørsmål som naturlig dukker opp.
Hva slags krefter er det f.eks. som virker i kjernen, mellom atomene i kjemiske
bindinger og i ulike aggregattilstander (fast stoff/væske og gass) ol.
Mangel på slik svar har igjen ført til at man bruker ulike modeller som ofte
er vanskelige å kombinere når man forklare ulike sider ved den samme naturen.
Et eksempel er kinetisk gassteori som har som mål å forklare ulike egenskaper
ved gasser, men som har problemer med å forklare tilsvarende fenomen i væsker
og fast stoff.
For
at man skal forstå naturen trenger man en modell av naturens byggesteiner; atomene.
Ifølge tradisjonelle lærebøker består atomene av en positiv kjerne og elektroner
som går i bane rundt omtrent slik som figuren til høyre antyder. (Den er hentet
fra en nettside). Bakgrunnen for at elektronene beveger seg rundt kjernen var
at man trengte en mekanisme som hindret de negative elektronene å bli trukket
helt inn i kjernen. I dag er vel alle enige om at denne atommodellen
er dårlig, men begrunnelsen for å bruke den er da at man ikke har noe bedre.
I tillegg til at denne atommodellen viser ting som vi positivt vet må være
feil, så gir den heller ikke svar på endel spørsmål som naturlig dukker opp.
Hva slags krefter er det f.eks. som virker i kjernen, mellom atomene i kjemiske
bindinger og i ulike aggregattilstander (fast stoff/væske og gass) ol.
Mangel på slik svar har igjen ført til at man bruker ulike modeller som ofte
er vanskelige å kombinere når man forklare ulike sider ved den samme naturen.
Et eksempel er kinetisk gassteori som har som mål å forklare ulike egenskaper
ved gasser, men som har problemer med å forklare tilsvarende fenomen i væsker
og fast stoff.
 Til høyre vises et øyeblikksbilde av en av
de mange animasjonenene vi kan finne på internett som illustrerer sammenhengen
mellom temperatur og den antatte bevegelsen til luftmolekylene. De 50 røde prikkene, som er luftmolekyler, vil i animasjonen beveger
seg hele tiden på en tilfeldig måte og støter elastisk mot veggene i beholderen.
Jo høyere man stiller temperaturen jo raskere beveger partiklene seg.
Til høyre vises et øyeblikksbilde av en av
de mange animasjonenene vi kan finne på internett som illustrerer sammenhengen
mellom temperatur og den antatte bevegelsen til luftmolekylene. De 50 røde prikkene, som er luftmolekyler, vil i animasjonen beveger
seg hele tiden på en tilfeldig måte og støter elastisk mot veggene i beholderen.
Jo høyere man stiller temperaturen jo raskere beveger partiklene seg.
Generelt kan man si at denne modellene kan forklare noe, men et kjennetegn
på dem er da at de også reiser mange nye spørsmål som de ikke gir noe svar
på. Problemstillingen her er da om det er lurt å bruke disse modellene i skoleverket.
Her vil vi kort presentere EM-modellen som da representerer
en alternativ forklaringsmodell som kan brukes i disse og andre sammenhengen. Fordelen
med denne modellen er at samme modell kan brukes til å forklare vidt forskjellige
naturfenomen.
EM-modellens forklaring av det kinetisk gassteori kan forklare
En annen presentasjon av EM-modellen her.
Ved normale temperatur og trykkforhold synes de fleste gasser å følge tilstandslikningen
(PV=konstant·T) og kinetisk gassteori kan da forklare denne sammenhengen om
man tenker seg at gassmolekyelene er ellastiske partikler som beveger seg med
svært høye hastigheter. Her vil vi kort vise hvordan EM-modellen forklarer tilstandslikningen.
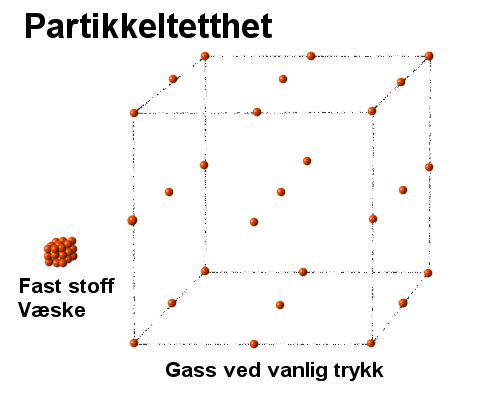 For
oversiktens skyld vil vi først nevne at gasser ved normalt trykk har en tetthet
som er ca 1/1000 del av tettheten til de samme stoffene når de er i fast eller
flytende form. Figuren til høyre viser da at avstanden mellom partiklene (atomene/molekylene)
vil bli 10-doblet når væske går over til gass. Dette er da en relativt stor
avstand. Om vi f.eks. stenger litt luft inn i en engangsprøyte og trykker på
stempelet vil vi oppleve at luften "fjærer", og det mest nærliggende
er da å tenke seg at luften fungere som ei fjær som da er et elastisk stoff.
Dette forutsetter imidlertid at det er frastøtingskrefter mellom partiklene,
og i utgangspunktet kan det være litt problematisk å tenke seg hva slags krefter
det i tilfelle er snakk om, siden de tilsynelatende virker mye lenger enn de
andre kreftene som virker internt i faste stoff og væsker.
For
oversiktens skyld vil vi først nevne at gasser ved normalt trykk har en tetthet
som er ca 1/1000 del av tettheten til de samme stoffene når de er i fast eller
flytende form. Figuren til høyre viser da at avstanden mellom partiklene (atomene/molekylene)
vil bli 10-doblet når væske går over til gass. Dette er da en relativt stor
avstand. Om vi f.eks. stenger litt luft inn i en engangsprøyte og trykker på
stempelet vil vi oppleve at luften "fjærer", og det mest nærliggende
er da å tenke seg at luften fungere som ei fjær som da er et elastisk stoff.
Dette forutsetter imidlertid at det er frastøtingskrefter mellom partiklene,
og i utgangspunktet kan det være litt problematisk å tenke seg hva slags krefter
det i tilfelle er snakk om, siden de tilsynelatende virker mye lenger enn de
andre kreftene som virker internt i faste stoff og væsker.
Ifølge EM-modellen er det elektriske frastøtingskrefter mellom negative
elektroner som summerer seg opp til den faskyvingskraften vi f.eks. kjenner
når vi presser sammen luft. Generelt er luftpartiklene elektrisk nøytrale og
grunnen til at vi likevel får elektriske fraskyvingskrefter har med geometri
å gjøre. Her vil vi da gi en kort innføring i hva som skiller partilkene i gasser
fra pratiklene i væsker og faste stoff.
Karbon er vanligvis et fast stoff (Solid)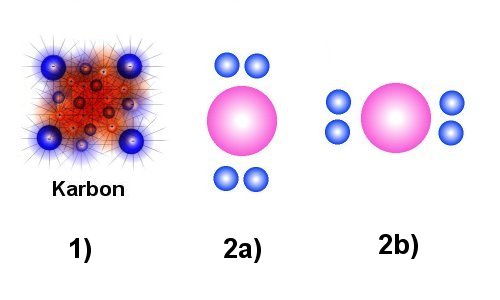
Figur
1) til høyre viser et karbonatom med ladninger og felt slik man kan tenke seg
det ifølge EM-modellen. I sentrum av den aktuelle "klumpen" vil det
da være en overvekt av positive ladninger, mens negative ladninger dominerer
i ytterkanten av atomet. Disse ytre elektronene vil da være litt magnetiske
og det er da tilhørende magnetiske krefter som hindrer at elektronene blir trukket
lenger innover mot den positive kjernen. Elektronene balanserer da mellom en
elektrisk tiltrekning og en magnetisk fraskyving i radiell retning, men langs
"overflaten" av atomet er det relativt små krefter som virke. I utgangspunktet
skulle man kanskje tro at de 4 ytre elektronen i et karbonatom ville plassere
seg i 4 hjørner fordi de har samme ladning. Ifølge EM-modellen er det da ikke
tilfelle og grunnen er at hvert av eletronene er små magneter. Også erfaring
med vanlige magneter viser at magneter har en tendens til å klumpe seg samme
to og to, og det vil da gjøre at de magnetiske kreftene nøytraliseres utad.
I figur 2) viser man da en alternativ måte å tegne karbonatomer hvor den
positivt dominerte kjernen er tegnet som en rød kule, mens de 4 ytre elektronene
er tegnet på vanlig måte. For å gjøre modellene enklere har vi her valgt å sløyfe
de elektriske og magnetiske feltene, men det er da viktig å tenke at de fortsatt
eksisterer selv om vi ikke kan se dem. Figurene viser da at elektronene har
klumpet seg sammen to og to. Karbon er et fast stoff under normale forhold og
grunnen er da følgende:
Kjennetegn på en ikke-gass: I en gass vil det som nevnt ovenfor
være elektrisk fraskyving mellom partiklene, men det gjelder da ikke væske og
fast stoff. Merk først at de magnetiske kreftene (~1/d³) fra de ulike partiklene
virker mye kortere enn de elektriske kreftene (~1/d²), og når det er snakk om
å finne ut hvilke stoff som vil klumpe seg samme (som væske/fast stoff) eller
sprees (som gass), så kan vi se bort fra de magnetiske kreftene her. Om vi
tenker oss at vi er plassert nær et karbonatom så vil vi utfra figurene
ovenfor relativt lett se at det er to mulige plasseringer som gir ulike elektriske
krefter. Om vi plasserer oss under det første atomet (2a) så vil det oppleves
positivt. En positiv ladning plassert under dette atomet vil altså gi fraskyving.
I det andre tilfellet (2b) vil vi få motsatt virkning. Dette har da sammenheng
med at det elektriske feltet rundt ulike ladninger vil variere som 1/d² og et
betyr at de ladningene som befinner seg nærmest vil dominere over dem som befinner
seg lenger borte. Selv om vi i dette tilfellet kan tenke oss at karbonatomer
vil fraskyve hverandre i visse tilfeller, så vil det i praksis skje en vridning
slik at det vil være de elektriske tiltrekningskreftene som vil dominere mellom
karbonatomer. I eksemplet ovenfor vil f.eks. de to karbonatomene tiltekkes og
vi får da et fast stoff. Nå forekommer karbon i ulike bindinger (i diamant og
grafitt), men poenget her er da bare at løse karbonatom ikke vil oppføre seg
som en gass hvor enkeltpartiklene fraskyver hverandre. .
Nitrogen er vanligvis en gass (gas)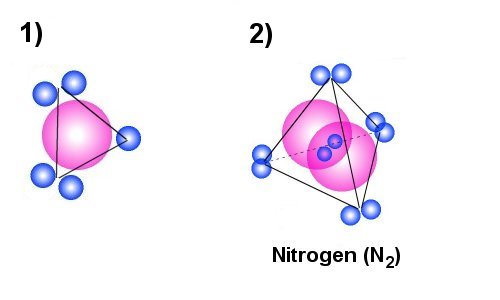
Nitrogen
følger etter karbon i det periodiske systemet, og årsaken til at nitrogen
er en gass under normale forhold har sammenheng med et ekstra elektron omkring kjernen
(til sammen 5 elektron ytterst). Figur 1) til venstre viser da hvordan vi kan tenke oss at nitrogen-atomet
ser ut. Hadde nitrogen-atomene eksistert som enkle nitrogen-atom i naturen,
så ville sannsynligvis også nitrogen vært et fast stoff. Problemet med
det aktuelle atomet er da at enslige elektronet (unpaired elektron) vil
virke som en magnet i forhold til andre stoff. Det som da naturlig vil skje
er at et annet nitrogenatom kobler seg sammen med det første. Figure 2) viser
da en tredimensjonell figur av hvordan man kan tenke seg de aktuelle ladningene
vil plassere seg i forhold til hverandre. Et elektronpar vil inngå som bindingselektron
og de er da tegnet mellom de to atomkjernene. De resterende 4 elektronparene
vil da plassere seg omkring som hjørnene i et tetraeder.
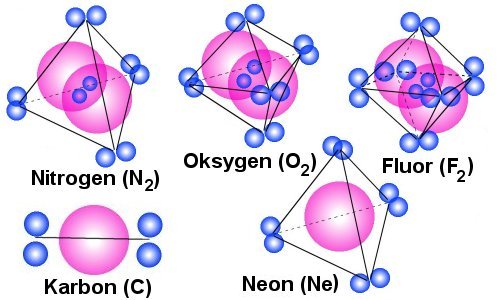 Kjennetegn
på en gass: I en gass vil det være elektrisk fraskyving mellom partiklene
uansett hvilke veg man vrir dem i forhold til hverandre. Dette vil da være tilfelle
i alle tilfellene til venstre bortsett fra karbon. Poenget er da at de aktuelle
elektronparene vil fordele seg omkring atom- eller molekyl-kjernene på en slik
måte at de vil oppleves som negativt ladet fra alle vinkler. I dette tilfelle
vil man da få det man opplever i praksis at en gass fyller alt rom den får tilgang
på. I prinsippet kan vi tenke oss at gassmolekylene ligger tilnærmet i ro med
tilnærmet lik avstand mellom hverandre, men i praksis vet vi at det foregår
en forholdsvis omfattende tilfeldig omplassering av molekyl i en gass, men dette
vi ikke gå videre inn på her.
Kjennetegn
på en gass: I en gass vil det være elektrisk fraskyving mellom partiklene
uansett hvilke veg man vrir dem i forhold til hverandre. Dette vil da være tilfelle
i alle tilfellene til venstre bortsett fra karbon. Poenget er da at de aktuelle
elektronparene vil fordele seg omkring atom- eller molekyl-kjernene på en slik
måte at de vil oppleves som negativt ladet fra alle vinkler. I dette tilfelle
vil man da få det man opplever i praksis at en gass fyller alt rom den får tilgang
på. I prinsippet kan vi tenke oss at gassmolekylene ligger tilnærmet i ro med
tilnærmet lik avstand mellom hverandre, men i praksis vet vi at det foregår
en forholdsvis omfattende tilfeldig omplassering av molekyl i en gass, men dette
vi ikke gå videre inn på her.
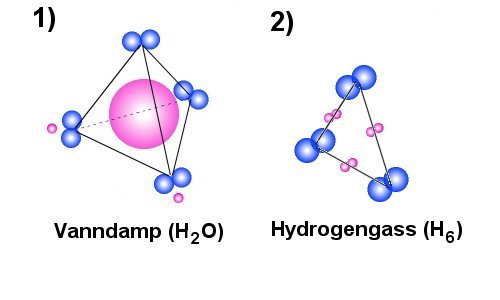 I
stedet vil vi kort vise figurer av et par andre stoff som opptrer som gass under
relativt vanlige betingelser. I praksis vil hydrogen alltid opptre som gass,
og en måte å forklare hvorfor er å tenke seg at 6 hydrogen-atom kobler seg sammen
slik som figur 2) viser. Da vil man oppleve at denne sammenstillingen vil fremstå
som negativt ladet i alle vinker.
I
stedet vil vi kort vise figurer av et par andre stoff som opptrer som gass under
relativt vanlige betingelser. I praksis vil hydrogen alltid opptre som gass,
og en måte å forklare hvorfor er å tenke seg at 6 hydrogen-atom kobler seg sammen
slik som figur 2) viser. Da vil man oppleve at denne sammenstillingen vil fremstå
som negativt ladet i alle vinker.
Vann er på den andre siden et stoff som opptrer som gass når temperaturen
overstiger 100°C (ved normalt trykk). I figur 1) har man et tetraeder hvor
hvert hjørne er negativt selv om de to protonene fra hydrogenatomene vil redusere ladningene på to
av hjørnene. Uten at vi vil gå inn på det her, så er det mulig å tenke seg at
en reduksjon av temperaturen vil skape en liten omplassering av de viste elektronene
og protonene som da gjør at de to hjørnene hvor protonene er plassert ikke lenger
vil fremstå som tilstrekkelig negative, og det vil da gjøre at vannmolekylene
opplever elektriske tiltrekning og klapper sammen til vann.
Sammenhengen mellom trykk og volum
Det som er nevnt ovenfor gir
da en mulig mekanisme som kan forklare hvorfor trykket øker når volumet minker
og omvendt. Det er altså snakk om elektriske krefter mellom gassmolekylene som
øker når gassmolekylene blir tettere. Nå er det i dette tilfelle ikke snakk
om en nøyaktig 1/d²-sammenheng, slik som man får omkring elementærladninger, og forklaringen
er da at en sammenpressing av gass også vil føre til intern sammenpressing av
gassmolekylene. Dette vil så igjen endre de elektriske egenskapene til gassmolekylene
og her vil vi bare oppsummere med å si at summen av alle de elektriske kreftene
gir verdier som er tilnærmet i samsvar med tilstandslikningen.
Sammenheng mellom temperatur og volum
Generelt vil vi her si at
temperatur er et uttrykk for vibrasjon i ladninger og her vil vi da konsentrere
oss om elektron-vibrasjoner. Protoner og kjerner er mye tyngre enn elektroner
og følgelig vil de ikke bli så lett påvirket av elektromagnetiske bølger i omgivelsene.
Animasjonen til høyre viser to atomkjerner som er bundet sammen med et elektronpar.
Slike bindinger har vi da i gassmolekyl, i væsker eller fast stoff. Erfaringer
har vist at de fleste stoff utvider seg når de blir oppvarmet og ifølge EM-modellen
skyldes det at bindingselektronene opptar mer plass jo mer de vibrerer slik
som vist til høyre. (Trykk på piltastene.) Det er ellers kjent at for høg temperatur vil bryte kjemiske
bindinger og dette er da en naturlig konsekvens av denne modellen. Når det gjelder
gassutvidelse ved oppvarming, så skjer den både mellom atomen og mellom molekylene.
Jo lenge fra hverandre de omkringliggende
elektronparene er, jo sterkere blir fraskyvingen mellom gassmolekylene.
I figuren ovenfor har vi også tegnet en elektromagnetisk bølge som vi
kan tenke oss er årsaken til elektronvibrasjonene eller forårsaket av elektronvibrasjonene.
Vi kan med andre ord tenke oss varme som energi som utveksles mellom elektronen
via elektromagnetiske bølger og et elektronpar vil da over tid sende ut like
mye energi som det mottar. På figuren er det da en halv bølgelengde mellom elektronene,
og det er da en betingelse for at elektronene skal kunne svinge med en tilfeldig
elektromagnetisk bølge som kommer forbi. Elektronparet har med andre ord en
egenfrekvens som blant annet er avhengig av avstanden mellom elektronene. Elektromagnetiske
bølger som ikke har frekvens i nærheten av denne eller eventuelle "overtoner"
vil da ikke påvirke elektronparet nevneverdig. I animasjonen over har da alle
bølgene samme frekvens/bølgelengde, men det er da amplituden/intensiteten som
bestemmer hvor mye elektronparet vil vibrere. Under vanlige forhold vil varme
inneholde mange ulike frekvenser og man tenker seg da at ulike elektronpar vekselvirker
med ulike bølger og et stoff som varmes opp vil da kunne absorbere de fleste
frekvensene fordi de har ulike elektronpar med ulike egenfrekvenser.
Tidsmessige årsaker gjør at vi ikke går videre med å forklare fenomen som
partikkelmodellen ikke kan forklare. Her vil vi da bare henvise til noen korte
kommentarer i den historiske delen.
EM-modellens forklaring av Brownske bevegelser
EM-modellens begrunnelse for irreversibilitet
 For
at man skal forstå naturen trenger man en modell av naturens byggesteiner; atomene.
Ifølge tradisjonelle lærebøker består atomene av en positiv kjerne og elektroner
som går i bane rundt omtrent slik som figuren til høyre antyder. (Den er hentet
fra en nettside). Bakgrunnen for at elektronene beveger seg rundt kjernen var
at man trengte en mekanisme som hindret de negative elektronene å bli trukket
helt inn i kjernen. I dag er vel alle enige om at denne atommodellen
er dårlig, men begrunnelsen for å bruke den er da at man ikke har noe bedre.
I tillegg til at denne atommodellen viser ting som vi positivt vet må være
feil, så gir den heller ikke svar på endel spørsmål som naturlig dukker opp.
Hva slags krefter er det f.eks. som virker i kjernen, mellom atomene i kjemiske
bindinger og i ulike aggregattilstander (fast stoff/væske og gass) ol.
Mangel på slik svar har igjen ført til at man bruker ulike modeller som ofte
er vanskelige å kombinere når man forklare ulike sider ved den samme naturen.
Et eksempel er kinetisk gassteori som har som mål å forklare ulike egenskaper
ved gasser, men som har problemer med å forklare tilsvarende fenomen i væsker
og fast stoff.
For
at man skal forstå naturen trenger man en modell av naturens byggesteiner; atomene.
Ifølge tradisjonelle lærebøker består atomene av en positiv kjerne og elektroner
som går i bane rundt omtrent slik som figuren til høyre antyder. (Den er hentet
fra en nettside). Bakgrunnen for at elektronene beveger seg rundt kjernen var
at man trengte en mekanisme som hindret de negative elektronene å bli trukket
helt inn i kjernen. I dag er vel alle enige om at denne atommodellen
er dårlig, men begrunnelsen for å bruke den er da at man ikke har noe bedre.
I tillegg til at denne atommodellen viser ting som vi positivt vet må være
feil, så gir den heller ikke svar på endel spørsmål som naturlig dukker opp.
Hva slags krefter er det f.eks. som virker i kjernen, mellom atomene i kjemiske
bindinger og i ulike aggregattilstander (fast stoff/væske og gass) ol.
Mangel på slik svar har igjen ført til at man bruker ulike modeller som ofte
er vanskelige å kombinere når man forklare ulike sider ved den samme naturen.
Et eksempel er kinetisk gassteori som har som mål å forklare ulike egenskaper
ved gasser, men som har problemer med å forklare tilsvarende fenomen i væsker
og fast stoff. Til høyre vises et øyeblikksbilde av en av
de mange animasjonenene vi kan finne på internett som illustrerer sammenhengen
mellom temperatur og den antatte bevegelsen til luftmolekylene. De 50 røde prikkene, som er luftmolekyler, vil i animasjonen beveger
seg hele tiden på en tilfeldig måte og støter elastisk mot veggene i beholderen.
Jo høyere man stiller temperaturen jo raskere beveger partiklene seg.
Til høyre vises et øyeblikksbilde av en av
de mange animasjonenene vi kan finne på internett som illustrerer sammenhengen
mellom temperatur og den antatte bevegelsen til luftmolekylene. De 50 røde prikkene, som er luftmolekyler, vil i animasjonen beveger
seg hele tiden på en tilfeldig måte og støter elastisk mot veggene i beholderen.
Jo høyere man stiller temperaturen jo raskere beveger partiklene seg.  For
oversiktens skyld vil vi først nevne at gasser ved normalt trykk har en tetthet
som er ca 1/1000 del av tettheten til de samme stoffene når de er i fast eller
flytende form. Figuren til høyre viser da at avstanden mellom partiklene (atomene/molekylene)
vil bli 10-doblet når væske går over til gass. Dette er da en relativt stor
avstand. Om vi f.eks. stenger litt luft inn i en engangsprøyte og trykker på
stempelet vil vi oppleve at luften "fjærer", og det mest nærliggende
er da å tenke seg at luften fungere som ei fjær som da er et elastisk stoff.
Dette forutsetter imidlertid at det er frastøtingskrefter mellom partiklene,
og i utgangspunktet kan det være litt problematisk å tenke seg hva slags krefter
det i tilfelle er snakk om, siden de tilsynelatende virker mye lenger enn de
andre kreftene som virker internt i faste stoff og væsker.
For
oversiktens skyld vil vi først nevne at gasser ved normalt trykk har en tetthet
som er ca 1/1000 del av tettheten til de samme stoffene når de er i fast eller
flytende form. Figuren til høyre viser da at avstanden mellom partiklene (atomene/molekylene)
vil bli 10-doblet når væske går over til gass. Dette er da en relativt stor
avstand. Om vi f.eks. stenger litt luft inn i en engangsprøyte og trykker på
stempelet vil vi oppleve at luften "fjærer", og det mest nærliggende
er da å tenke seg at luften fungere som ei fjær som da er et elastisk stoff.
Dette forutsetter imidlertid at det er frastøtingskrefter mellom partiklene,
og i utgangspunktet kan det være litt problematisk å tenke seg hva slags krefter
det i tilfelle er snakk om, siden de tilsynelatende virker mye lenger enn de
andre kreftene som virker internt i faste stoff og væsker. 

 Kjennetegn
på en gass: I en gass vil det være elektrisk fraskyving mellom partiklene
uansett hvilke veg man vrir dem i forhold til hverandre. Dette vil da være tilfelle
i alle tilfellene til venstre bortsett fra karbon. Poenget er da at de aktuelle
elektronparene vil fordele seg omkring atom- eller molekyl-kjernene på en slik
måte at de vil oppleves som negativt ladet fra alle vinkler. I dette tilfelle
vil man da få det man opplever i praksis at en gass fyller alt rom den får tilgang
på. I prinsippet kan vi tenke oss at gassmolekylene ligger tilnærmet i ro med
tilnærmet lik avstand mellom hverandre, men i praksis vet vi at det foregår
en forholdsvis omfattende tilfeldig omplassering av molekyl i en gass, men dette
vi ikke gå videre inn på her.
Kjennetegn
på en gass: I en gass vil det være elektrisk fraskyving mellom partiklene
uansett hvilke veg man vrir dem i forhold til hverandre. Dette vil da være tilfelle
i alle tilfellene til venstre bortsett fra karbon. Poenget er da at de aktuelle
elektronparene vil fordele seg omkring atom- eller molekyl-kjernene på en slik
måte at de vil oppleves som negativt ladet fra alle vinkler. I dette tilfelle
vil man da få det man opplever i praksis at en gass fyller alt rom den får tilgang
på. I prinsippet kan vi tenke oss at gassmolekylene ligger tilnærmet i ro med
tilnærmet lik avstand mellom hverandre, men i praksis vet vi at det foregår
en forholdsvis omfattende tilfeldig omplassering av molekyl i en gass, men dette
vi ikke gå videre inn på her.  I
stedet vil vi kort vise figurer av et par andre stoff som opptrer som gass under
relativt vanlige betingelser. I praksis vil hydrogen alltid opptre som gass,
og en måte å forklare hvorfor er å tenke seg at 6 hydrogen-atom kobler seg sammen
slik som figur 2) viser. Da vil man oppleve at denne sammenstillingen vil fremstå
som negativt ladet i alle vinker.
I
stedet vil vi kort vise figurer av et par andre stoff som opptrer som gass under
relativt vanlige betingelser. I praksis vil hydrogen alltid opptre som gass,
og en måte å forklare hvorfor er å tenke seg at 6 hydrogen-atom kobler seg sammen
slik som figur 2) viser. Da vil man oppleve at denne sammenstillingen vil fremstå
som negativt ladet i alle vinker.