Hvordan brukes partikkelmodellen i dagens lærebøker?
(ikke ferdig)
Fra læreplanverket (L97):
8.klasse
-gjere forsøk
og bruke ein partikkelmodell til å beskrive sentrale
eigenskapar ved gassar, væsker og
faste stoff, faseovergangar og
samanengen mellom temperatur og rørsla til
partiklane
Fra kursbeskrivelse U1 (etterutdanningskurs for lærere i forbindelse med
L97):
Metode: -begynne med kortfattet innføring i N&M i
L97
-skal bruke partikkelmodellen i beskrivelsene
Tema:
-Egenskaper ved gasser
-Egenskaper ved
væske
-Egenskaper ved faste
stoffer
-Faseoverganger
-Temperatur
(partikkelbevegelser)
-Diffusjon og osmose
1 Begrepsforenkling
- Snakker om "partikler" i stedet for å bruke
mer presise ord. (strøm = partikkeltransport)
Partikkel (= smådel) Lite legeme, støvpartikkel også brukt
om atomer, molekyler, ladede og uladede elementærpartikler. (Store Norske
leksikon)
2 Kinetisk gassteori
- betrakter molekylene i gass som elastiske
partikler som støter mot veggene og lager trykk. Gjennomsnittshastigheten
for partiklene har da sammenheng med temperaturen. (kinetisk
partikkelteori)
Kinetisk gassteori - teoretisk beskrivelse av gassers
fysiske egenskaper der de observerbare mikroskopiske egenskapene forklares som
et resultat av de enkelte molekylers bevegelse. Kinetisk gassteori bygger på den
klassiske fysikks bevegelseslikninger for enkelte molekyler, og summen av
molekylenes virkninger finnes ved statistiske betraktninger.(Store Norske
leksikon)
Gassteori - forkortet betegnelse på kinetisk gassteori som
går ut på at molekylene i en gass beveger seg fritt om hverandre uten
nevneverdig tiltrekningskrefter mellom seg. Molekylene har stor hastighet og
deres gjennomsnittshastighet er et uttrykk for gassens temperatur. Deres støt
mot karveggene betinger gassens trykk og deres støt mot hverandre betinger
gassens utvidelse hvis den har anledning til å utvide seg... Den [teorien] viser
god overensstemmelse med erfaringer og er av grunnleggende betydning for teorien
om stråling og atomteoriens oppfatning av materien. (Store Norske leksikon)
3 Kvantemodell
- teori som sier at alt i naturen kan beskrives som
både kontinuerlige bølger og kvantiserte partikler, avhengig av situasjonen. Det
som særlig kjennetegner modellen er at elektromagnetiske bølger som f.eks. lys
antaes å være kvantisert. Man sier altså at lys består av fotoner som da er en
form for partikler.
Kvantemekanikk danner grunnlaget for den moderne
beskrivelsen av mikrokosmos, d.v.s. av elektroner, atomer og atomære systemer av
subatomære partikler (elementærpartikler). Kvantemekanikken bygger på
undersøkelser som viser at materien har en dualistisk natur. d.v.s. at den dels
viser bølgeegenskaper, dels partikkelegenskaper. Bølgeegenskapene kommer først
og fremst til syne som interferens, f.eks. elektroninterferens og diffraksjon.
Partikkelnaturen gjør seg gjeldene ved at en rekke størrelser som ladning, masse
og spinn opptrer i form av udelelige minstekvanter. En beskrivelse hvorav både
bølge- og partikkel-egenskapene lot seg avlede ble først gitt av E. Schrödinger
og W. Heisenberg i 1925. Deres teori danner grunnlaget for den
ikkerelativistiske kvantemekanikk, tidligere ofte kalt bølgemekanikk. Den
relativistiske kvantemekanikk ble først utformet av A. M. Dirac i 1928.
Kvantemekanikken danner grunnlaget for kvantestatistikken. I nær relasjon og i
blant inbefattet i betegnelsen kvantemekanikk, står dessuten kvanteteorien som
danner grunnlaget for beskrivelsen av vekselvirkningskreftenr mellom partikler
og dannelse og annihilasjon av partikler... (Store Norske leksikon)
Temperatur (latin:blande) - begrep som blir brukt til å
beskrive følelsen av kaldt og varmt... I fysikken bruker man en gjenstands
temperatur som et av begrepene til å beskrive tilstanden til gjenstanden eller
stoffet i den... Alle stoffer sender ved alle temperaturer ut elektromagnetiske
bølger som temperaturstråling... Ved stadig nedkjøling av et stoff skulle man
kunne få en tilstand hvor molekylene ikke lenger er i bevegelse, et absolutt
nullpunkt for temperatur.
Varme ...[ifølge teori] en form for energioverføring. Når to
systemer med forskjellig temperatur er i kontakt med hverandre, vil molekylene i
det ene systemet overføre noe av sin bevegelseenergi til molekylene i det andre
systemet; det blir utført arbeid mellom molekylene. Det er dette molekylarbeidet
som er varme. En annen form for varme er stråling...Lys ...
Lyset viser etter kvanteteorien en dualitet. Det består av kvanter, fortoner oge
er samtidig elektromagnetiske bølger. Dualiteten innebærer ikke noe
selvmotsigelse, men er et uttrykk for at bilder vi henter fra dagliglivet er
utilstrekkelige når det gjelder å beskrive naturens fundamentale
egenskaper...(Store Norske leksikon)
Undervisningseksempler som kan virke forvirrende
Generelt er det slik at man vender seg til det meste, og vår tid er vel
spesielt karakterisert av at folk flest godtar det meste så lenge det er snakk
om såkalte "seriøse kilder" (f.eks. lærebøker og professorer i fysikk).
Tidligere var man kanskje litt mer skeptiske til påstander som virket urimelige
eller uforståelige. Her vil vi da gi noen eksempler på noen klipp fra
lærebøker som kan oppleves forvirrende for de som prøver å forstå naturen og
spørsmålet er da om partikkelmodellen egentlig fremmer forståelse for de aktuelle fenomenene.
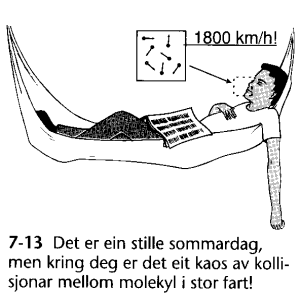
|
Utrolig raske molekyl!
Ifølge partikkelmodellen
har luftmolekylene en hastighet omkring 500 m/s eller 1800 km/h
ved 20°C. Lydhastigheten
er til sammenlikning 340 m/s. Teorien forteller videre at luftmolekylene
kolliderer med hverandre og omgivelsene ca 109 ganger pr sekund og at
de da beveger seg 10-7 m i gjennomsnitt mellom hver kollisjon. Alle
sammenstøt er ellers elastiske slik at farten før og etter et støt vil være
tilnærmet lik. Dette "action-bildet" står da i en slags motsetning til et mer
nærliggende bilde av stillestående luft som noe relativt rolig noe.
(Figuren
er fra Ergo 2Fy s166 Asch.1997)
|
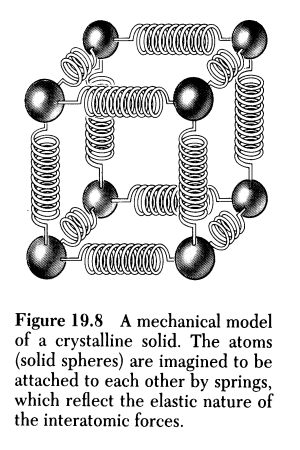
|
Krefter eller ikke?
Figuren til høyre viser
en modell hvor man illustrerer kreftene mellom partiklene i
fast stoff som fjærer og denne modellen kan da forklare varmeutvidelse,
spredning av lyd ol. I denne sammenhengen er det noen som har problemer
med å forestille seg hva som overfører lyd i gasser hvor det er
en grunnleggende antakelse at det ikke er krefter mellom molekylene
mellom sammenstøtene. Hva slags krefter er det ellers snakk om der
hvor denne modellen har tegnet fjærer
(Serway: Physics for Scientists and Engineers p 513 1990)
|
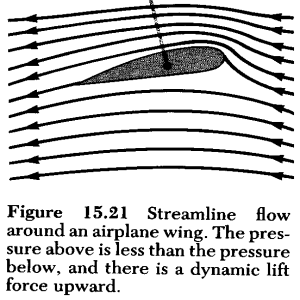
|
Hvorfor blir trykket mindre
jo raskere luftstrømmene er?
Det er da dette prinsippet
som gjør at fly kan fly, og for å utnytte dette prinsippet maksimalt har
flyvingene sin karakteristiske form slik som figuren viser.
Når lufttrykk blir mindre kan det f.eks. bety at luftmolekylene trekker
seg sammen men det er da ikke forrenelig med
partikkelmodellen for gass. Det er vel også årsaken til at man vanligvis nevner
slike fenomen som er knyttet opp mot Bernoullis lov i andre sammenhenger
(kapitler) enn de man behandler partikkelmodellen.
(Serway: Physics for Scientists and Engineers p 407 1990)
|
|

En av de bedre modellene fra ei lærebok som viser forskjellen
på is, vann og vanndamp. Men for mange vil den reise nye spørsmål om hva slags krefter
som holder vannmolekylene sammen (De samme som holder ismolekyelene
sammen?)
(Univ.91 Nat7-9 Infobok s31)
|

I lærebøker er det ikke vanlig å oppgi konkrete tallverdier, sannsynligvis
fordi de er "uforståelige". Her er det imidlertid gjort, og mange
vil vel føle at det er vanskelig å forestille seg at vannmolekylene
har en hastighet på 600 m/s når molekylhastigheten i luften over
kanskje har en hastighet på 500m/s. (Trykkfeil som fagkonsulentene
ikke har oppdaget?)
|
|
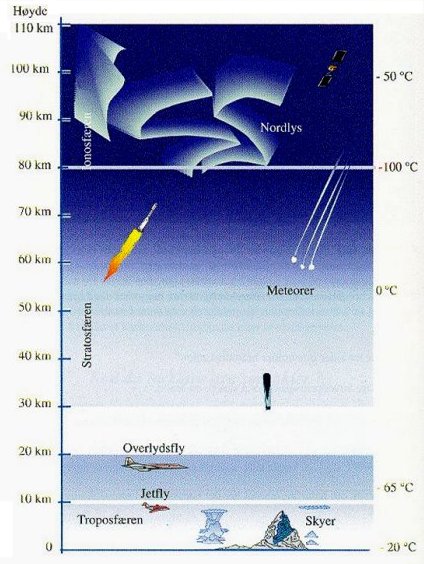
Er det kaldt eller varmt i universet?
Når vi
beveger oss oppover i atmosfæren vil temperaturen avta. Om vi har med oss et
termometer og måler temperaturen på en høy fjelltopp og nede ved sjøen så vil vi
altså måle lavere temperatur i høyden. Så langt er det ok, selv om det kanskje
ikke er så enkelt å forklare hvorfor det er slik. Skulle det ikke f.eks. bli varmere jo
nærmere vi kommer sola? Her vil vi da bare si at denne temperaturfornadningen
har sammenheng med trykkforandringen. (NKS97 Forsøk og fakta 8 s192)
|
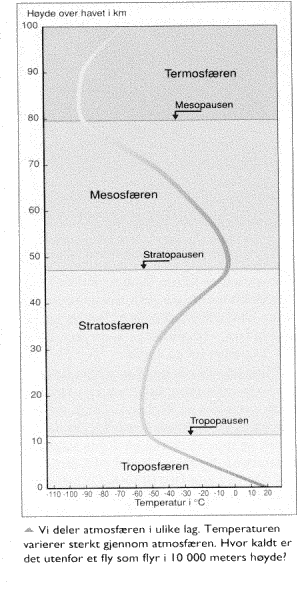
Hvordan forklarer så en lærer de
aktuelle temperaturopplysningene som er vist i figurene her?
(Gyldendal97 Natur og
miljøfag 8 s61)
|
 Utdrag fra kompendium av Johs. Tveita 1994: Elevaktive undervisningsmetoder i naturfag
brukt til å formidle den kinetiske partikkelteorien for stoffa
Utdrag fra kompendium av Johs. Tveita 1994: Elevaktive undervisningsmetoder i naturfag
brukt til å formidle den kinetiske partikkelteorien for stoffa
(s9:) Den kinetiske partikkelmodellen
Her
skal vi først undersøke om elevene sjøl har utvikla en modell for gass, og
hvordan denne modellen er. Oftest finner en to ulike modeller: 
Modell 1:
Gass er sammenhengende (kontinuum) og elastisk (gummi)
Modell 2: Gass er bygd
opp av mange små partikler med mye tomrom imellom, og det gjør at den kan
presses sammen.
Det er vanlig at de fleste elevene heller mest til den første
modellen, men den andre modellen får etterhvert noen elever tro på etterhvert
som de blir eldre...
(s11:) Dersom ingen kommer med partikkelidéen bør du komme fram med den. La dem
først få drøfte denne ideen for å finne svakheter og fordeler med den. La
elevene prøve å presse sammen f.eks. 10 ml luft til så lite som mulig. En kan
med slike forsøk konkludere med at det mellom partiklene må være mye
tomrom!...
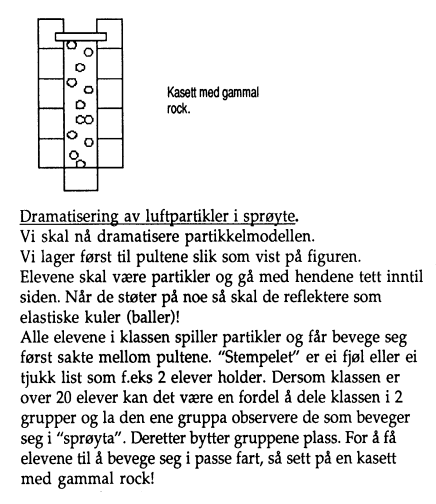 (s15:) ... Alle [elevene] avgrenser en viss
luftmengde i sprøyta ved å tette for med en finger og læreren stiller spørsmål:
(s15:) ... Alle [elevene] avgrenser en viss
luftmengde i sprøyta ved å tette for med en finger og læreren stiller spørsmål:
Er partiklene i ro? (Nei, de er i stadig bevegelser)
Har de stor
fart? (Ja, farten er faktisk i gjennomsnitt nesten 500 m/s)
Er det
mange? (Svært mange! Tallet er faktisk så stort at vi kan vanskelig
forestille oss det! 1ml inneholder 1019 partikler! Jeg er usikker på
om en bør fortelle dette til elevene for det kan avspore!? Kanskje bør en bare
si flere tusen for det har elevene kanskje begrep om?)
Alle elevene
presser nå stempelet inn slik at luftmengda blir omtrent halvert og en stiller
f.eks. disse spørsmåla:
Synes du trykket mot stempelet er det samme så lenge
det er inntrykt til samme sted på sprøyta eller forandrer det seg?
Har
partiklene endret fart? (Nei)
Kolliderer partiklene oftere med
stemplet nå enn i starten? (Ja, for de har mindre område å bevege seg
på!)
På nettet finnes det ellers et nettsted for kjemiundervisning "the ChemTeam"
(http://dbhs.wvusd.k12.ca.us/ChemTeamIndex.html)
hvor man har følgende beskrivelse av partikkelmodellen:
The Kinetic Molecular Theory
of Ideal Gases
These statements are made only for what is called an ideal gas. They cannot
all be rigorously applied (i.e. mathematically) to real gases, but can be used
to explain their observed behavior qualitatively.
1. All matter is composed of tiny, discrete particles (molecules or
atoms).
2. Ideal gases consist of small particles (molecules or atoms) that are far
apart in comparison to their own size. The molecules of a gas are very small
compared to the distances between them.
3. These particles are considered to be dimensionless points which occupy
zero volume. The volume of real gas molecules is assumed to be negligible for
most purposes.
This above statement is NOT TRUE. Real gas molecules do occupy
volume and it does have an impact on the behavior of the gas. This impact WILL
BE IGNORED when discussing ideal gases.
4. These particles are in rapid, random, constant straight line motion. This
motion can be described by well-defined and established laws of motion.
5. There are no attractive forces between gas molecules or between molecules
and the sides of the container with which they collide.
In a real gas, there actually is attraction between the molecules of
a gas. Once again, this attraction WILL BE IGNORED when discussing ideal gases.
6. Molecules collide with one another and the sides of the container.
7. Energy is conserved in these collisions, although one molecule may gain
energy at the expense of the other.
8. Energy can be transferred in collisions among molecules.
9. Energy is distributed among the molecules in a particular fashion known as
the Maxwell-Boltzmann Distribution.
10. At any paticular instant, the molecules in a given sample of gas do not
all possess the same amount of energy. The average kinetic energy of all the
molecules is proportional to the absolute temperature. |
Det å først si noe og så si det motsatte slik som rød tekst ovenfor
markerer, er vanligvis forvirrende i en undervisningsituasjon. De aktuelle motsigelsene er imidlertid innebygget
i kinetisk partikkelmodell, og elever og studenter vil sannsynligvis plages
med dem så lenge partikkelmodellen brukes i skoleverket.
Trenger vi
egentlig en modell som skaper flere spørsmål enn den svarer på?







 Utdrag fra kompendium av Johs. Tveita 1994: Elevaktive undervisningsmetoder i naturfag
brukt til å formidle den kinetiske partikkelteorien for stoffa
Utdrag fra kompendium av Johs. Tveita 1994: Elevaktive undervisningsmetoder i naturfag
brukt til å formidle den kinetiske partikkelteorien for stoffa 
 (s15:) ... Alle [elevene] avgrenser en viss
luftmengde i sprøyta ved å tette for med en finger og læreren stiller spørsmål:
(s15:) ... Alle [elevene] avgrenser en viss
luftmengde i sprøyta ved å tette for med en finger og læreren stiller spørsmål: