 Overgang mellom fast stoff, væske og gass
Overgang mellom fast stoff, væske og gass Overgang mellom fast stoff, væske og gass
Overgang mellom fast stoff, væske og gassDen
viktigste faktoren som avgjør hvilke gruppe et stoff befinner seg i er
da energiinnholdet (varme / indre energi). Alle stoff vil opptre som fast stoff
når temperaturen er tilstrekkelig lav og alle stoff vil opptre som gass
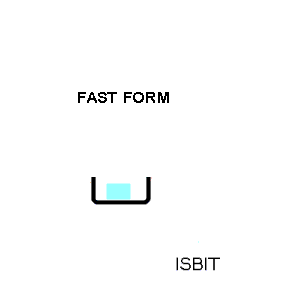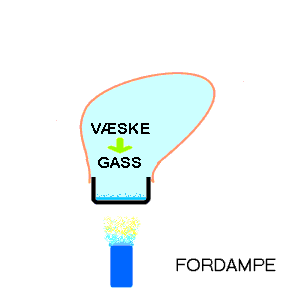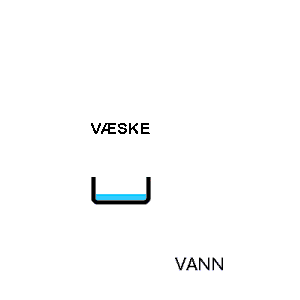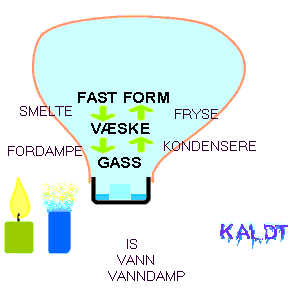
når temperaturen er tilstrekkelig høy. Figuren viser en demonstrasjon av faseovergangene for
vann. En isbit i et telysbeger kan vi få til å smelte med
et stearinlys. Om vi skal fordampe vannet og beholde det som damp i en
ballong trenger vi en gassbrenner (gir større effekt). Når vi
så slutter å tilføre energi vil vanndampen kondensere
til vann og om vi videre setter dette vannet på et kaldt sted vil
vannet fryse til is.
Trykk på 'oppdater'/'reload'
i nettlesermenyen for å få figuren til å gjennomgå de
ulike faseovergangene i rekkefølge.
 Kjemisk og fysisk lagring av energi
Kjemisk og fysisk lagring av energiVed en forbrenning får vi alltid ut energi i form av varme. Hvis vi
omdanner vanndamp til vann så får vi også ut energi. Det skjer
altså energiutveksling med omgivelsene både når vi har kjemiske
omforminger og fysiske omforminger. Det som skjer i figuren til høyre
kan beskrives ved hjelp av stoff-formler og energi-formler
slik som vist til under.
Figuren og tabellen viser at fotsyntese og fordamping krever energi i form
av lys og varme, mens forbrenning og kondensering avgir den samme energien som
lys og varme. Både når det gjelder energiomdanning og stoffomdanningen
så kan vi betrakte prosessene til høyre som motsatte av de som
er til venstre.
|
CO2+H2O
-> karbohydrater+O2 |
karbohydrater+O2
-> CO2+H2O |
H2O
-> H2O
|
H2O
-> H2O
|